
题目列表(包括答案和解析)
(⑸题3分,其余每空2分,共15分)四种短周期元素A、D、E、G,原子序数依次增大,A、G同主族,D、E同周期;A和D、E、G的单质都可以在一定条件下化合依次生成共价化合物甲、乙和离子化合物丙,丙和乙剧烈反应得到强碱溶液X和A的单质。请回答:
⑴化合物丙和乙的反应的化学方程式是________________ ;
⑵A和E两种元素构成的一种化合物,其水溶液显弱酸性,试用恰当的方程式解释该溶液呈弱酸性的原因_____________________________________________________ ;
⑶将A、D、E三种元素构成的一种化合物与X恰好反应,所得溶液呈碱性;试用恰当的方程式解释该溶液呈碱性的原因__________________________________________,该溶液中存在的离子有(请用离子符号按浓度由大到小的顺序以“>”连接填写)__________________________________________ ;
⑷在丙和乙的反应中,当转移1.5mol电子时,得到A单质__________ g;若同时得到X的溶液0.50L,则所得溶液的物质的量浓度为__________________________。
⑸工业制取甲的反应为:D2(g)+3A2(g) 2甲(g) ;△H<0 。若改变下列任何一个条件(其它条件不变)时,上述平衡一定向右移动的是(填写序号)_________________ (3分) 。
2甲(g) ;△H<0 。若改变下列任何一个条件(其它条件不变)时,上述平衡一定向右移动的是(填写序号)_________________ (3分) 。
A.将甲不断从反应体系中分离 B.减小反应体系的压强 C.降低反应体系的温度
D.加入适当的催化剂 E.向体系中充入D2和A2
(⑸题3分,其余每空2分,共15分)四种短周期元素A、D、E、G,原子序数依次增大,A、G同主族,D、E同周期;A和D、E、G的单质都可以在一定条件下化合依次生成共价化合物甲、乙和离子化合物丙,丙和乙剧烈反应得到强碱溶液X和A的单质。请回答:
⑴化合物丙和乙的反应的化学方程式是________________ ;
⑵A和E两种元素构成的一种化合物,其水溶液显弱酸性,试用恰当的方程式解释该溶液呈弱酸性的原因_____________________________________________________ ;
⑶将A、D、E三种元素构成的一种化合物与X恰好反应,所得溶液呈碱性;试用恰当的方程式解释该溶液呈碱性的原因__________________________________________,该溶液中存在的离子有(请用离子符号按浓度由大到小的顺序以“>”连接填写)__________________________________________ ;
⑷在丙和乙的反应中,当转移1.5mol电子时,得到A单质__________ g;若同时得到X的溶液0.50L,则所得溶液的物质的量浓度为__________________________。
⑸工业制取甲的反应为:D2(g)+3A2(g) 2甲(g) ;△H<0 。若改变下列任何一个条件(其它条件不变)时,上述平衡一定向右移动的是(填写序号)_________________ (3分) 。
2甲(g) ;△H<0 。若改变下列任何一个条件(其它条件不变)时,上述平衡一定向右移动的是(填写序号)_________________ (3分) 。
A.将甲不断从反应体系中分离 B.减小反应体系的压强 C.降低反应体系的温度
D.加入适当的催化剂 E.向体系中充入D2和A2
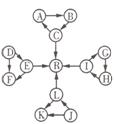 (每空2分,共8分)某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应
(每空2分,共8分)某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应![]() 物或生成物已略去):
物或生成物已略去):
已知:①图中每个小三角形的三种物质中至少含有一种相同元素,K与L含有完全相同的元素;②D、J为固体单质,R为气体单质,其余物质为常见化合物;③A能使品红溶液褪色,也能使澄清石灰变浑浊,C的浓溶液与固体J在加热条件下反应生成A、L以及水;④E为淡黄色化合物,E与L或水反应都能生成R;⑤I为氧化物,I与F或C都![]() 能反应;G和L反应生成白色胶状沉淀H,H具有较强的吸附性。根据以上信息,
能反应;G和L反应生成白色胶状沉淀H,H具有较强的吸附性。根据以上信息,![]() 回答下列问题:
回答下列问题:
(1)写出下列反应的化学方程式:
①D→F:________________________________。
②L→R:________________________________。
(![]() 2)写出下列反应的离子方程式:
2)写出下列反应的离子方程式:
①G中通入过量CO2:__________________________。
②I→G:________________________________。
(每空2分,共8分)某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应 物或生成物已略去):
物或生成物已略去):
已知:①图中每个小三角形的三种物质中至少含有一种相同元素,K与L含有完全相同的元素;②D、J为固体单质,R为气体单质,其余物质为常见化合物;③A能使品红溶液褪色,也能使澄清石灰变浑浊,C的浓溶液与固体J在加热条件下反应生成A、L以及水;④E为淡黄色化合物,E与L或水反应都能生成R;⑤I为氧化物,I与F或C都 能反应;G和L反应生成白色胶状沉淀H,H具有较强的吸附性。根据以上信息,
能反应;G和L反应生成白色胶状沉淀H,H具有较强的吸附性。根据以上信息, 回答下列问题:
回答下列问题:
(1)写出下列反应的化学方程式:
①D→F:________________________________。
②L→R:________________________________。
( 2)写出下列反应的离子方程式:
2)写出下列反应的离子方程式:
①G中通入过量CO2:__________________________。
②I→G:________________________________。
(14分,每空2分)
硫酸亚铁容易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体,其反应如下:Fe+H2SO4(稀) FeSO4+H2↑
FeSO4+(NH4)2SO4+6H2O
(NH4)2SO4·FeSO4·6H2O
步骤l:在盛有适量铁屑的锥形瓶里加入某种试剂除去油污,加热,充分反应后过滤、
洗涤、干燥、称量,铁屑质量为 。
。
步骤2:将处理过的铁屑加入到一定量的稀H2SO4中,加热至50℃—80℃充分反应,
趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为 。
。
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,
缓缓加热一段时间,将其冷却结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为 。
。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是 (填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)步骤2中趁热过滤的目的是 。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为 。
(4)铁屑表面常有少量的铁锈(Fe2O3· H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答)
。[来源:Zxxk.Com]
H2O),对FeSO4的制备 (填“有”、“无”)影响,理由是(用离子方程式回答)
。[来源:Zxxk.Com]
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为 。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水(简述实验操作、现象和结论) 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com