
题目列表(包括答案和解析)
|
NH4Cl溶于重水(D2O)生成的一水合氨分子和水合氢离子的化学式是 | |
| [ ] | |
A. |
NH3·D2O和HD2O+ |
B. |
NH3·HDO和D3O+ |
C. |
NH2D·D2O和DH2O+ |
D. |
NH2D·HDO和D3O+ |
NH4Cl溶于重水(D2O)生成一水合氨分子和水合氢离子的化学式是( )
A. NH3 ?D2O和HD2O+ B. NH3?HDO和D3O+
C. NH2D?D2O和DH2O+ D.NH2D?HDO和D3O+
氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,每生成1molNH3放出热量为 ;
(2)在体积为2L的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)2NH3(g) △H<0,得到如下数据:
| 实验组 | 温度℃ | 起始量/mol | 2分钟/mol | 平衡常数 | |
| H2 | N2 | NH3 | |||
| 1 | 298 | 6 | 2 | 1.2 | 4.1×106 |
| 2 | 398 | 3 | 1 | 0.8 | K1 |
请回答下列问题:
① K1的相对大小,K1_______4.1×106(填写“>”“=”或“<”);
②实验1中以υ(H2) 表示的反应速率为 ;
③下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母);
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2
B.υ(N2)(正) =3υ(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)在一定条件下合成氨反应达平衡后,在恒容条件下充入氦气,正反应速率 (填“增大”“减小”“不变”,在恒压条件下,充入氦气,平衡 移动(“正向”“逆向”“不”)
(4) NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是 。
氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,每生成1molNH3放出热量为 ;
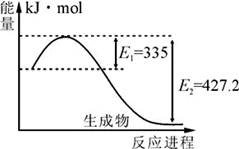
(2)在体积为2L的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g)
△H<0,得到如下数据:
2NH3(g)
△H<0,得到如下数据:
|
实验组 |
温度℃ |
起始量/mol |
2分钟/mol |
平衡常数 |
|
|
H2 |
N2 |
NH3 |
|||
|
1 |
298 |
6 |
2 |
1.2 |
4.1×106 |
|
2 |
398 |
3 |
1 |
0.8 |
K1 |
请回答下列问题:
① K1的相对大小,K1_______4.1×106(填写“>”“=”或“<”);
②实验1中以υ(H2) 表示的反应速率为 ;
③下列各项能作为判断该反应达到化学平衡状态的依据的是 (填序号字母);
A.容器内N2、H2、NH3的物质的量浓度之比为1∶3∶2
B.υ(N2)(正) =3υ(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)在一定条件下合成氨反应达平衡后,在恒容条件下充入氦气,正反应速率 (填“增大”“减小”“不变”,在恒压条件下,充入氦气,平衡 移动(“正向”“逆向”“不”)
(4) NH4Cl溶液呈酸性,这是由于NH4+水解的缘故。则NH4Cl在重水(D2O)中水解的离子方程式是 。

| ||
| (一定条件) |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com