
题目列表(包括答案和解析)
某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。
(1)称取两种固体各2 g,分别放入两个小烧杯中,再各滴加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液。
① 发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论????????? ???????????????? ? 。
② 同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象是 ??? (填字母序号)。
? A.溶液温度下降? B.溶液温度升高??? C.滴入酚酞后呈浅红色? ????? D.滴入酚酞后呈红色
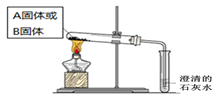
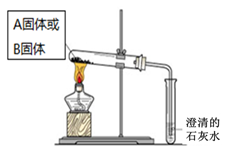
(2)如下面左图所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清。请用化学方程式解释澄清石灰水中发生的现象???????????????????? 。


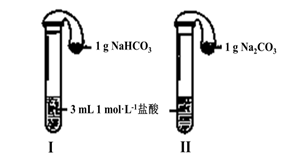
(3)如上图所示,在气密性良好的装置I和II中分别放入试剂,将气球内的固体同时倒入试管中。
两试管中均产生气体,????????? (填“I”或“II”)的反应程度更为剧烈。
② 反应结束后,气球均有膨胀,恢复至室温。下列说法正确的是????????? 。
A.装置I的气球体积较大???????????? B.装置II的气球体积较大
C.生成气体的体积根据盐酸计算?????? D.生成气体的体积根据固体计算
(4)将两种固体分别配制成0.5 mol·L-1的溶液,探究与0.5 mol·L-1CaCl2溶液反应的情况
实验方案 | 预测现象 | 预测依据 | 实际结果 |
实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 | 有白色沉淀 |
实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 | 有白色沉淀出现,同时有少量气泡冒出。 |
请写出上述实验过程中发生的反应的离子方程式:
实验1:???????????????? ????? ???????????? ;实验2:???????????????????? ?????? ?????? 。
某实验小组欲通过以下实验来探究Na2CO3和NaHCO3两种物质的性质。
(1)称取两种固体各2 g,分别放入两个小烧杯中,再各滴加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,并恢复至室温后,向所得溶液中各滴入2滴酚酞试液。
① 发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得到结论 。
② 同学们在两烧杯中还观察到了其它现象。其中,盛放Na2CO3的烧杯中出现的现象是 (填字母序号)。
A.溶液温度下降 B.溶液温度升高 C.滴入酚酞后呈浅红色 D.滴入酚酞后呈红色
(2)如下面左图所示分别加热A、B固体,发现固体A受热产生的气体能使澄清石灰水变浑浊,但一段时间后浑浊又变澄清。请用化学方程式解释澄清石灰水中发生的现象 。

(3)如上图所示,在气密性良好的装置I和II中分别放入试剂,将气球内的固体同时倒入试管中。
两试管中均产生气体, (填“I”或“II”)的反应程度更为剧烈。
② 反应结束后,气球均有膨胀,恢复至室温。下列说法正确的是 。
A.装置I的气球体积较大 B.装置II的气球体积较大
C.生成气体的体积根据盐酸计算 D.生成气体的体积根据固体计算
(4)将两种固体分别配制成0.5 mol·L-1的溶液,探究与0.5 mol·L-1CaCl2溶液反应的情况
| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 | 有白色沉淀 |
| 实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 | 有白色沉淀出现,同时有少量气泡冒出。 |
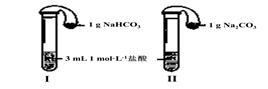
| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 | 有白色沉淀 |
| 实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 | 有白色沉淀出现,同时有少量气泡冒出。 |
| 实验方案 | 预测现象 | 预测依据 | 实际结果 |
| 实验1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 有白色 沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应。 | 有白色沉淀 |
| 实验2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液 | 无白色 沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。 | 有白色沉淀出现,同时有少量气泡冒出。 |

四种盐在不同温度下的溶解度(g/
温度 溶解度 盐 | ||||||||
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | — |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
(说明:①>
请回答以下问题:
(1)装置的连接顺序应是__________(填字母)。
(2)A装置中盛放的试剂是__________,其作用是__________。
(3)在实验过程中,需要控制D温度在30—
(4)反应结束后,将锥形瓶浸在冷水中析出NaHCO3晶体的原因是____________________
_____________________。用蒸馏水洗涤NaHCO3晶体的目的是除去____________杂质(以化学式表示)。
(5)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1—2滴酚酞指示剂,用物质的量浓度为c mol·L-1的HCl溶液滴定至溶液由红色到无色(指示![]() +H+
+H+![]()
![]() 反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_______________________________。
反应的终点),所用HCl溶液体积为V1 mL,再加1—2滴甲基橙指示剂,继续用HCl溶液滴定溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=_______________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com