
题目列表(包括答案和解析)
 Ⅰ常温下,向100mL0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
Ⅰ常温下,向100mL0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:| 溶质 | CH3COONa | NaHCO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 10.3 | 11.1 | 11.3 |
| A、将该Na2CO3溶液转移至250mL容量瓶中,加蒸馏水稀释至刻度线,摇匀 | B、将该Na2CO3溶液转移至250mL烧杯中,用量筒量取150mL蒸馏水加入,搅拌 | C、将该Na2CO3溶液转移至500mL烧杯中,用量筒量取400mL蒸馏水加入,搅拌 | D、将该Na2CO3溶液转移至500mL容量瓶中,加蒸馏水稀释至刻度线,摇匀 |
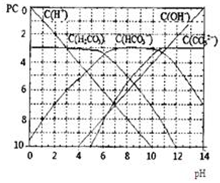 pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:
pC类似pH,是指极稀溶液中,溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol/L,则该溶液中溶质的pC=-lg1×10-3=3.图为H2CO3在加入强酸或强碱溶液后,平衡时溶液中三种成分的pC-pH图.请回答下列问题:湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com