
题目列表(包括答案和解析)
对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),在体积固定的密闭容器中反应,下列能够说明该反应达到化学平衡状态的标志是 ( )
2SO3(g),在体积固定的密闭容器中反应,下列能够说明该反应达到化学平衡状态的标志是 ( )
A.单位时间内生成n molO2的同时,生成2n mol SO3
B.用SO2、O2、SO3表示的反应速率之比为2∶1∶2的状态
C.混合气体的质量不再变化的状态
D.混合气体的密度不再变化的状态
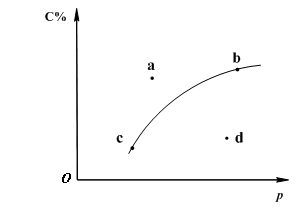
对于可逆反应2A(?)+B(g)![]() 2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
(1)物质A的状态是 (填“气体”、“液体”或“固体”);
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是 ;
(3)在a、b、c三种条件下达平衡时,v(a)、v(b)、v(c)按由大到小排序___________;
 |
|
(4)对于2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是
;如果在恒容容器中,仅把另外82%的其他气体“抽出来”,是否会减小SO2的转化率 (填“会”或“不会”)。
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
| c2(CO) |
| c(CO2) |
| c2(CO) |
| c(CO2) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com