
题目列表(包括答案和解析)
右边框图中的物质是中学化学中常见的物质,已知B、E在常温下为气态,其余均为固体,其中D是一种淡黄色固体。试根据框图和所学知识回答下列问题:
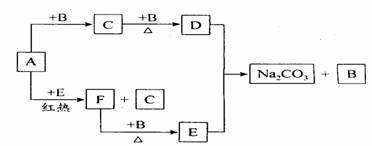
(1)写出D的化学式和E的电子式:D的化学式 、E的电子式 。
(2)A+E→C+F的反应方程式为 。
(3)往饱和Na2CO3溶液中不断通入E气体,会看到溶液变浑浊(有白色固体析出),写出该反应的化学方程式 。
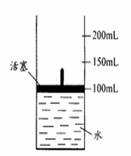
(4)将A、D按一定比例投入下图容器的水中,活塞由100mL处上升到200mL处。现用电火花引燃容器内的气体,在条件不变的情况下,若活塞由200mL处回到150mL处,则原则来投入的A、D物质的物质的量之比为n(A)∶n(D)= 。(假设上述操作能顺利实现,且忽略因投入A、D以及气体溶于水使水面高度变化的影响。)


将102 g由氮气和氢气按1:3的物质的量之比组成的混合气体,在一定条件下通入密闭容器中反应,当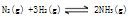 达到平衡后,平衡混合气体平均相对分子质量为12.5,则其中含氨的质量为
达到平衡后,平衡混合气体平均相对分子质量为12.5,则其中含氨的质量为
A.32.64 g B.65.28 g C. 3.84 g D. 38.4 g
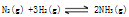 达到平衡后,平衡混合气体平均相对分子质量为12.5,则其中含氨的质量为
达到平衡后,平衡混合气体平均相对分子质量为12.5,则其中含氨的质量为| A.32.64 g | B.65.28 g | C.3.84 g | D.38.4 g |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com