
题目列表(包括答案和解析)
| A、水的离子积常数KW随温度改变而改变,随外加酸碱浓度改变而改变 | B、一元弱酸的电离常数Ka越小,表示此温度下该一元弱酸电离程度越大 | C、对已达到化学平衡的反应,仅改变浓度,若平衡移动则平衡常数(K)一定改变 | D、Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关 |
下列说法正确的是:( )
A.反应A(g) 2B(g);△H,若正反应的活化能为Ea kJ
mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
2B(g);△H,若正反应的活化能为Ea kJ
mol-1,逆反应的活化能为Eb kJ·mol-1,则△H=(Ea-Eb)kJ·mol-1
B.已知25℃时,有关弱酸的电离平衡常数:HCN Ka=4.9×10-10 ; H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11。则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2=2HCN+Na2CO3
C.已知:
|
共价键 |
C-C |
C=C |
C-H |
H-H |
|
键能/ kJ·mol-1 |
348 |
610 |
413 |
436 |
则反应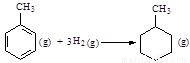 的焓变为ΔH
= -384
kJ·mol-1
的焓变为ΔH
= -384
kJ·mol-1
D、一定浓度的NaOH溶液,温度升高PH值不变
下列说法正确的是( )
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2O MgCl2+6H2O
MgCl2+6H2O
B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。
|
化学式 |
电离常数 |
|
HClO |
K1=3×10-8 |
|
H2CO3 |
K1=4.3×10-7 |
|
K2=5.6×10-11 |
C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一。
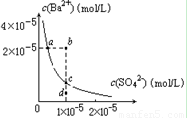
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)·c(SO42-)。则加入 Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。
下列说法正确的是( )
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2O MgCl2+6H2O
MgCl2+6H2O
B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。
|
化学式 |
电离常数 |
|
HClO |
K1=3×10-8 |
|
H2CO3 |
K1=4.3×10-7 |
|
K2=5.6×10-11 |
C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一。
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)·c(SO42-)。则加入 Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。

| 化学式 | 电离常数 |
| HClO | K1=3×10-8 |
| H2CO3 | K2=4.3×10-7 |
| K3=5.6×10-11 |
A.用坩埚灼烧MgCl2?6H2O的反应式 MgCl2?6H2O
| ||||
| B.根据表中提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) | ||||
| C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一 | ||||
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)?c(SO42-).则加入Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点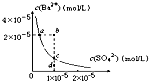 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com