
题目列表(包括答案和解析)


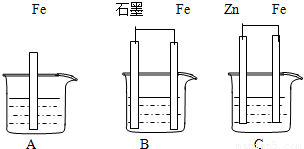
 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
A、B、C、D 四种短周期元素,原子序数依次增大, A 原子的最外层上有 5 个电子; B 的阴离子和 C 的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体 E , D 的 L 层电子数等于 K、M 两个电子层上的电子数之和。 ( 1 ) A 的最高价氧化物的水化物是___________(填化学式);
( 2 )物质 E 中所包含的化学键有______________,写出 C、D 两元素形成的化合物 C2D 的电子式______________________;
( 3 )把盛有 48mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为 24 mL,则原混合气体中 AB 的体积分数为__________。
(每空 2 分,共 8 分)
(12分)A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有5个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,D的L层电子数等于K、M两个电子层上的电子数之和。
(1)A的最高价氧化物对应的水化物是_______(填化学式);
(2)物质E中所包含的化学键有________,写出C、D两元素形成的化合物C2D的电子式_________;
(3)在同主族氢化物的递变性质中,A的氢化物沸点反常,这可以用 解释。
A.共价键 B.离子键 C.氢键 D.范德华力
(4)与C同主族且处于第七周期的元素的原子序数是 .
(5)把盛有48 mL AB、AB2混合气体的容器倒置于水中(同温、同压下),待液面稳定后,容器内气体体积变为24 mL,则原混合气体中AB的体积分数为_______ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com