
题目列表(包括答案和解析)
(Ⅰ)下列实验操作或实验叙述正确的是( )
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体
E.实验室制取氨气时,常用无水氯化钙进行干燥
F.加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42-
(Ⅱ)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;
乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3,和Cu(OH)2的混合物。
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水]
(1)按照甲同学的观点,发生反应的离子方程式为______________________ ;在探究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为______________________。
(2)洗涤所得沉淀的实验操作方法:_____________________________________________
(Ⅲ)若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。

(1)实验装置的连接顺序为_________________________________
(2)装置C中碱石灰的作用是__________,实验开始和结束时都要通过量的空气,请说明结束时通入过量空气的作用是__________________________________ 。
(3)若沉淀样品的质量为mg,装置B质量增加了ng,则沉淀中CuCO3的质量分数为 ______________
(11分)(Ⅰ)下列实验操作或实验叙述正确的是 。
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体
E.实验室制取氨气时,常用无水氯化钙进行干燥
F.加入BaCl2溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,一定有SO42-
(Ⅱ)某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3; 乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3,和Cu(OH)2的混合物。
[查阅资料知:CuCO3和Cu(OH)2均不带结晶水]
(1)按照甲同学的观点,发生反应的离子方程式为______________________ ;在探
究沉淀成分前,须将沉淀从溶液中分离并净化。其具体操作依次为 。
(2)若丙同学的观点正确,可利用下列装置通过实验测定其组成。
①实验装置的连接顺序为_________________________________。
②装置C中碱石灰的作用是__________,实验开始和结束时都要通过量的空气,请说明结束时通入过量空气的作用是__________________________________ 。
③若沉淀样品的质量为mg,装置B质量增加了ng,则沉淀中CuCO3的质量分数为 ______________。
(12分)氯气是一种重要的工业原料。
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4  2CaSO4+2Cl2↑+2H2O
2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验。
(1)回答下列问题:(1)该实验中A部分的装置是 (填标号) 。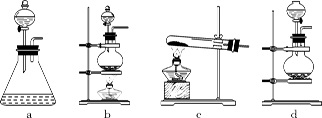
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤): 。
(3)写出D装置中发生反应的离子方程式 (4)该实验存在明显的缺陷,请你提出改进的方法 。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L?1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2 === Na2S4O6+2NaI,共用去Na2S2O3溶液20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为 。
实验室可通过多条途径得到氮气,常见的三种方法是:
方法一:将氨气通过灼热的氧化铜粉末,得到纯净的氮气和铜。
方法二:将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末。
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,逸出氮气。
下列是进行实验时可选择的实验仪器(其它必要的仪器如:铁架台、铁夹、铁圈、石棉网、
酒精灯等未列出):
请回答下列问题:
(1)方法一制氮气:氨气是用浓氨水跟生石灰反应得到,此反应最好选用(填仪器的编号)
_________作发生装置,该反应的化学方程式_________________________。
要制取并收集纯净的氮气(可含有少量的水),还应使用上述仪器中的(填仪器的编号,
并按气流方向从左向右列出)_______________________________________________。
(2)制取氮气的三种方法中,方法一和方法二越来越受到人们的关注,经常被联合使用。
这两种方法与方法三相比,其优越性在于①____________ ______________________,
②_________________________________________。(至少写两点)
(11分)(Ⅰ)下列实验操作或实验叙述正确的是 。
| A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁 |
| B.用酸式滴定管量取18.80mL的碳酸钠溶液 |
| C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低 |
| D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com