
题目列表(包括答案和解析)
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)  2NH3(g)
△H=一92. 4 KJ·mol-1
2NH3(g)
△H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g)
+3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g)
+3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
A.①③④ B.①②④⑤ C.①④⑤ D.②③④
(2)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2]。

t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO:和0. 40 molNH3 ,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
|
时间/min |
0 |
30 |
70 |
80 |
100 |
|
n(CO2) /mol |
0.10 |
0.060 |
0.040 |
0.040 |
0.040 |
①20 min时,υ正(CO2 )_ 80 min时。υ逆(H2O)(填“>”、“=”或“<”)。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将_ (填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_ (保留二位小数)。
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图像;保持其它条件不变;则(t+10)℃下正确的图像可能是 (填图甲中的“A”或“B”)。

⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 ,若两极共收集到气体22. 4L(标
况),则消耗的尿素为 g(忽略气体的溶解)。
氨气在工农业生产中有重要应用。
(1)①氮气用于工业合成氨,写出氮气的电子式 ;
②NH3的稳定性比PH3 (填写“强”或“弱”)。
(2)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。
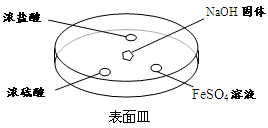
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为 。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是 (写化学式,一种即可)。
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括
Fe2++2NH3·H2O=Fe(OH)2↓+ 2NH4+ 和 。
(3)空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,用平衡移动原理解释其原因 。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为 ,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为 g(小数点后保留两位有效数字)。
氨气在工农业生产中有重要应用。
(1)①氮气用于工业合成氨,写出氮气的电子式 ;
②NH3的稳定性比PH3 (填写“强”或“弱”)。
(2)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为 。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是 (写化学式,一种即可)。
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括
Fe2++2NH3·H2O=Fe(OH)2↓+ 2NH4+ 和 。
(3)空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,用平衡移动原理解释其原因 。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为 ,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为 g(小数点后保留两位有效数字)。
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)  2NH3(g) △H=一92. 4 KJ·mol-1
2NH3(g) △H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
| A.①③④ | B.①②④⑤ | C.①④⑤ | D.②③④ |
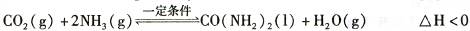
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2) /mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com