
题目列表(包括答案和解析)
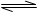 2NH3(g)的△H= 。
2NH3(g)的△H= 。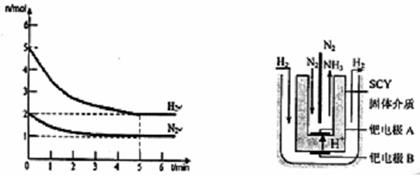
| | H2C2O4 | KHC2O4 | K2C2O4 |
| pH | 2.0 | 3.1 | 8.1 |
 已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)
已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)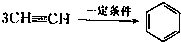 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式: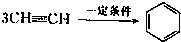 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:______.
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:______.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com