
题目列表(包括答案和解析)
(14分)磷酸(H3PO4)在水中可分三步电离,能够以H3PO4、H2PO- 4、HPO2- 4、PO3- 4等四种粒子形式存在,当溶液的pH发生变化时,其中任一粒子的物质的量占四种粒子总物质的量的分数δ(分布分数)也可能发生变化。图1是某浓度H3PO4溶液中各种粒子的物质的量分数δ随pH的变化曲线。用NaOH标准溶液滴定该H3PO4溶液,绘得滴定曲线如图2。

图1 H3PO4粒子分部分数与pH关系 图2 H3PO4滴定曲线(部分)
(注:图中曲线1表示H3PO4、曲线2表示H2PO- 4、曲线3表示HPO2- 4、曲线4表示PO3- 4)
(1)H3PO4第一步电离的电离常数K1的表达式为_______,K1的数值最接近(填字母)______。
A.10-2.1 B.10-4.7 C.10-7 D.10-9.7
(2)用NaOH滴定H3PO4,写出反应从a点到b点的离子方程式____________________,当滴定至pH=7时,溶液主要存在的阴离子(OH-除外)有_______________。
(3)在Na3PO4溶液中, ____3(填“>”、“<”、“=”),原因是__________________(用离子方程式表示)。
____3(填“>”、“<”、“=”),原因是__________________(用离子方程式表示)。
(4)磷酸钙、磷酸一氢钙和磷酸二氢钙是三种重要的磷酸盐,在食品、化肥等方面应用广泛。其20℃时溶解度数据如下表:
|
名称 |
化学式 |
20℃时溶解度(g) |
|
磷酸钙 |
Ca3(PO4)2 |
2×10-3 |
|
磷酸一氢钙 |
CaHPO4 |
4.3×10-3 |
|
磷酸二氢钙 |
Ca(H2PO4)2 |
1.8 |
磷酸钙在水中溶解度很小,但易溶于稀盐酸。结合平衡移动原理分析其原因
_________________________________________________________________。
(7分)已知: A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平的标志。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
回答下列问题:
(1)B、D分子中官能团名称分别是 、 。
(2)写出下列反应的反应类型:① 反应,
② 反应,④ 反应。
(3)写出下列反应的化学方程式:
③ ;④
(共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: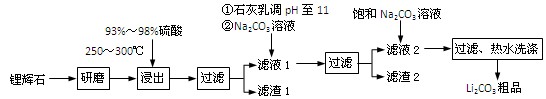
已知:① Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
| T/℃ | 20 | 40 | 60 | 80 |
 (Li2CO3)/g (Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
 (Li2SO4)/g (Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

(7分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:

(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是: 。
(3)浓硫酸的作用是:① ;② 。
(4)饱和碳酸钠溶液的主要作用是
。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com