
题目列表(包括答案和解析)
A.平衡时容器内的压强是原来的0.8倍
B.M的平均反应速率为0.15 mol·L-1·min-1
C.x的值为1
D.平衡时P的浓度为0.25 mol·L-1
|
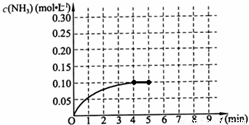
在一定温度下,把3.0 moL M和2.5 moL N混合于2.0 L的密闭容器中,发生反应的化学方程式为:3M(g)+N(g) | |
| [ ] | |
A. |
X的值为1 |
B. |
M的平均反应速率为0.15 mol·L-1·min-1 |
C. |
M的转化率为60% |
D. |
平衡时P的浓度为0.25 mol·L-1 |
(14分)(1)在一定温度下,将2molA和2molB两种气体混合于2L密闭容器中,发生反应:3A(g)+2B(g) xC(g)+2D(g)ΔH <0 ,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.2mol/L。由此推断:
① x值等于 ; ② B的平衡浓度为 。
③ A的转化率为 。
④由于条件改变而引起反应速率和化学平衡的变化情况,a---b过程中改变的条件可能是 ;b----c过程中改变的条件可能是 ; 之后若增大压强时,请把反应速率变化情况画在上图中的c-----d处(标明V正和V逆) 该条件下反应建立新平衡后体系中混合气体的平均相对分子质量 (填“增大”或“减小”或“不变”)。



| ||
| ||
| ||
| 高温高压 |
| ||
| 高温高压 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com