
题目列表(包括答案和解析)
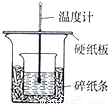
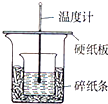 实验室利用如图装置进行中和热的测定,请回答下列问题:
实验室利用如图装置进行中和热的测定,请回答下列问题:| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
实验室用燃烧法测定某种α―氨基酸X (CxHyOzNp)的分子组成。取1.67 g X放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图所示装置进行实验(铁架台、铁夹、酒精灯等未画出),请回答有关问题:
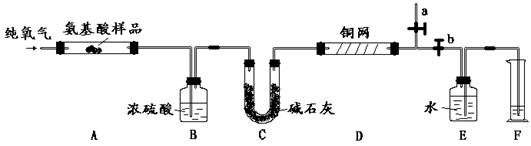
(1)实验开始时,首先打开止水夹a,关闭止水夹b,通一段时间的纯氧,这样做的目的是
;
之后则需关闭止水夹 ,打开止水夹 。
(2)以上装置中需要加热的有(填装置代号) 。操作时应先点燃 处的酒精灯。
(3)装置A中发生反应的化学方程式为
CxHyOzNp+ O2![]() CO2+ H2O+ N2
CO2+ H2O+ N2
(4)装置D的作用是 ;
(5)实验结果:
① B中浓硫酸增重0.81 g,C中碱石灰增重3.52 g,F中收集到112 mL标准状况气体。
② X的相对分子质量为167,它是通过 测定的(填一种现代化学仪器)
试通过计算确定该有机物X的分子式(写出计算过程)。
|
(6)1.67 g X最多能中和0.2 mol/L 的NaOH溶液100 mL。结论是 ;
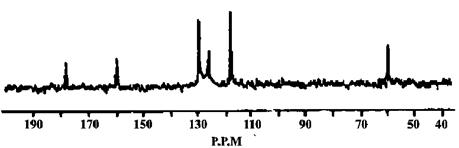
有机物X的13C-NMR(即核磁共振碳谱,作用与核磁共振氢谱类似)如下图。试确定有机物X的结构简式为 。
实验室用MnO2作催化剂加热分解KClO3制备O2,是在1820年由德贝莱钠首次实现的.当时发现气态产物有异味,后来用实验证明其中含少量Cl2和O3等杂质,而O3比O2的氧化性更强,它跟还原剂反应时通常生成O2.碳酸钴(CoCO3)在加热时能跟O2发生反应,可表示为:
xCoCO3+![]() O2
O2![]() xCO2+CoxOy(褐色)
xCO2+CoxOy(褐色)
现在利用下图装置测定固体CoxOy的组成.
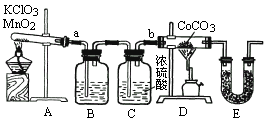
请回答:
(1)E装置的U型管内应填充的试剂是(填字母)
[ ]
(2)实验时,若将接口a与b直接相连,而不用B、C装置,会导致测定结果产生偏差,其原因是________.
(3)B装置内所盛试剂可以是(填字母)
[ ]
(4)实验结束时,若先撤去A装置中的酒精灯,会引起________.
(5)CoCO3完全转化为褐色的CoxOy后,称得E管质量增加4.4g,D管内残留物质量为8.3g,通过计算求CoxOy中的x∶y=________.
(14分)酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究。
(1)用右图装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定。
①从实验装置上看,图中尚缺少的一种玻璃仪器是 。
②大小烧杯之间填满纸屑的作用是 。
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值 (填 “偏高”、“偏低”或“无影响”)。
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。 其具体实验步骤如下:
①应选择 滴定管(填写图中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化, 即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com