
题目列表(包括答案和解析)
A.把盛有溶液的分液漏斗放在铁架台的铁圈中
B.把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞
C.检验分液漏斗活塞和上口的玻璃塞是否漏液
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正
E.旋开活塞,用烧杯接收溶液
F.从分液漏斗上口倒出上层溶液
G.将漏斗上口的玻璃塞打开或是塞上的凹槽或小孔对准漏斗口上的小孔
H.静置、分层
就此实验,完成下列填空。
(1)正确操作步骤的顺序是:(用编号字母填写)
__________→__________→__________→A→G→__________→E→F
(2)选用CCl4从碘水中萃取碘的原因是________________________________________。
(3)上述E步骤的操作应注意________________________________________________。
(4)上述G操作的目的是____________________________________________________。
(5)下列物质中,不能作为从碘水中萃取碘的溶剂是( )
A.苯 B.酒精 C.汽油 D.乙酸
某校化学课外小组用海带为原料制取少量碘水,现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,其实验操作可分解为如下几步:
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收溶液;
F.从分液漏斗上口倒出上层溶液;
G.将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
H.静置、分层。
就此实验,完成下列填空:
(1)正确操作步骤的顺序是(用编号字母填写):
________→________→________→A→G→________→E→F。
(2)选用CCl4从碘水中萃取碘的原因是
________________________________________________________________________
________________________________________________________________________。
(3)上述E步骤的操作应注意
________________________________________________________________________
________________________________________________________________________。
(4)上述G操作的目的是
________________________________________________________________________。
(5)下列物质中,不能作为从碘水中萃取碘的溶剂是________。
A.苯 B.酒精
C.汽油 D.乙酸
| ||
| 高温高压 |
| 时间(h) 物质的量(mol) |
0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
 (1)我国农业因遭受酸雨而造成的损失每年高达15亿多元,酸雨是指pH小于
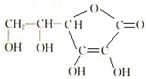
(1)我国农业因遭受酸雨而造成的损失每年高达15亿多元,酸雨是指pH小于 化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起到十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.| 1 |
| 2 |
| 1 |
| 2 |
| 物质的量/(mol)/时间(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com