
题目列表(包括答案和解析)
(共12分)
(1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g) pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。

①该反应的平衡常数表达式为(各物质浓度的指数用数值表示): 。
②若充入A,K值 (填一定增大、一定减小、或可能增大也可能减小、不变);正反应速率____(填增大、减小、不变)。
③若体积为10升的密闭容器中,500℃、有催化剂存在的条件下,根据图示回答下列问题:在0~15min内的平均反应速率:v(B)=
(2)对于某可逆反应:A(g)+B(g) 2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:

①写出t2时改变的条件可能是: (用文字表达);
②t4时改交的条件可能是 (用编号表示,多选扣分)
A.增大压强 B.减小压强
C.使用催化剂 D.升高温度
E.增大A的浓度
(每空2分共计12分)某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如 图所示。
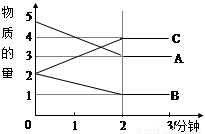
①则该反应的的反应物是 ,生成物是 ,
②化学方程式为 ;
③反应开始至2分钟时,能否用C表示反应速率?
④若能,其反应速率为 ,若不能,则其原因为 ;
⑤2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态。
(12分)化学平衡原理在工农业生产中发挥着重要的指导作用。
(1)反应C(s)+CO2(g)
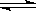 2CO(g)平衡常数K的表达式为
;
2CO(g)平衡常数K的表达式为
;
已知C(s) +
H2O(g)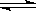 CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常数为K1;H2(g)+CO2(g) 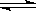 CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为
。
CO(g)+H2O(g)的平衡常数为K2 ,则K与K1、K2二者的关系为
。
(2) 已知某温度下,反应2SO2+O2 2SO3,的平衡常数K=19
2SO3,的平衡常数K=19
在该温度下的体积固定的密闭容器中充入C(SO2)=1mol·L-1,C(O2)=1 mol·L-1,当反应在该温度下SO2转化率为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向 (填“正反应”或“逆反应”) 方向进行。
(3)对于可逆反应:aA(g) +bB(g) cC(g)+dD(g)
△H = a kJ·mol-1;
cC(g)+dD(g)
△H = a kJ·mol-1;
若a+b>c+d,增大压强平衡向_______(填“正反应”或“逆反应”)方向移动;若升高温度,平衡向逆反应方向移动,则a_______0(填“>”或“<”)
(12分)某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
⑴制备硫酸亚铁溶液,最合适的试剂组为 ▲ (填编号);
a.过量铁屑和稀硫酸 b.过量稀硫酸和铁屑 c.过量硫酸铁溶液和铁屑
⑵实验室保存硫酸亚铁溶液的一般方法是__________▲ ___________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
|
烧杯编号 |
① |
② |
③ |
|
加入试剂 |
铁粉0.1g |
铁粉0.1g,0.1mol/LH2SO43mL |
0.1mol/LH2SO43mL |
|
红色出现时间(天) |
1天 |
4天左右 |
8天以上 |
⑶在烧杯②中加入2种试剂后,即可观察到的现象为 ▲ ;
⑷通过比较上述3组实验,可以得出的结论为 ▲ ;
⑸硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大。
① 试用一个离子方程式表示上述反应过程中的变化 ▲ ;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因 ▲ 。
(共12分)
(1)在某容积不变的密闭容器中,有可逆反应:mA(g)+nB(g) pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
pC(g)+qD(S)△H<0如图某反应过程中各物质物质的量n(mol)随时间t的变化曲线图。
①该反应的平衡常数表达式为(各物质浓度的指数用数值表示): 。
②若充入A,K值 (填一定增大、一定减小、或可能增大也可能减小、不变);正反应速率____(填增大、减小、不变)。
③若体积为10升的密闭容器中,500℃、有催化剂存在的条件下,根据图示回答下列问题:在0~15min内的平均反应速率:v(B)=
(2)对于某可逆反应:A(g)+B(g) 2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
2C(g) △H<0。若该反应的正反应速率与时间的关系如图所示。在其它条件不变的情况下,请填空:
①写出t2时改变的条件可能是: (用文字表达);
②t4时改交的条件可能是 (用编号表示,多选扣分)
A.增大压强 B.减小压强
C.使用催化剂 D.升高温度
E.增大A的浓度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com