
题目列表(包括答案和解析)
(11分)某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
(1)第1步:灼烧。操作是将足量海带灼烧成灰烬。该过程中将使用到的硅酸盐质实验仪器有________(填代号,限填3项)。
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三脚架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
(2)第2步:I-溶液的获取。操作是________________________。
(3)第3步:氧化。操作是依次加入合适的试剂。下列氧化剂最好选用________(填代号)。
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2
理由是__________________________________。
(4)第4步:碘单质的检验。操作是____________________________。
(4分)某同学为了测定镁铝合金中镁的质量分数,取3.9克镁铝合金投入足量的盐酸中,测得生成气体的体积为4.48L(标准状况),请计算该合金中镁的质量分数。(假设合金中不含其它金属)
(7分)某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置。
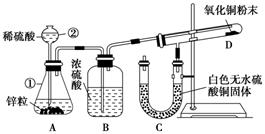
(1)写出编号仪器的名称:
①________,②________。
(2)浓硫酸的作用是_________________________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1个水分子,转移的电子数为________。
(4分) 某同学为了测定镁铝合金中镁的质量分数,取3.9克镁铝合金投入足量的盐酸中,测得生成气体的体积为4.48L(标准状况),请计算该合金中镁的质量分数。(假设合金中不含其它金属)
(7分)某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置。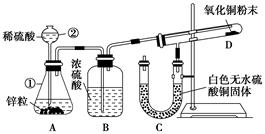
(1)写出编号仪器的名称:
①________,②________。
(2)浓硫酸的作用是_________________________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1个水分子,转移的电子数为________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com