
题目列表(包括答案和解析)
某化学兴趣小组测定某Fe2(SO4)3样品(只含少量FeCl2杂质)中铁元素的质量分数,按以下实验步骤进行操作:
①称取a g样品,置于烧杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸馏水,使样品溶解,然后准确配制成250.00 mL溶液;
③量取25.00 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦……
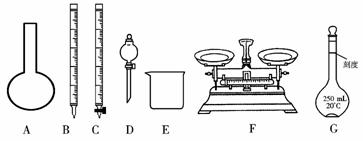
请根据上面叙述,回答:
(1)上图所示仪器中,本实验步骤①②③中必须用到的仪器有E和____________(填字母)。
(2)步骤②中:配制50 mL,1.0 mol/L稀H2SO4需要98%(密度1.84 g/cm3)的浓H2SO4体积为____________ mL,量取该体积的浓H2SO4用到量筒规格是____________。
(3)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
□Fe2++□ClO2□□=□Fe3++□Cl-+□H2O
从理论上分析,上述实验中若将氯水改为ClO2时,对实验结果造成____________(填“偏大”“偏小”或“不影响”),等物质的量的ClO2与Cl2的氧化效率之比为____________。
(4)第⑥步的操作中,将沉淀物转移到____________(填仪器名称)中加热,冷却至室温,称量其质量为m1 g,再次加热并冷却至室温称量其质量为m2 g,若m1与m2差值较大,接下来的操作应当是____________。
(5)若步骤⑥不在干燥器中冷却,则测定的铁元素的质量分数会____________(填“偏大”“偏小”或“不影响”);若容器质量是W1 g,最终容器和固体的总质量是W2 g,则样品中铁元素的质量分数为____________(列出算式,不需化简)。
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和 (填字母)。

(2)步骤②加入盐酸的目的是 ;加快样品溶解的最简单操作是 。
(3)写出步骤③中发生反应的离子方程式 。
(4)步骤⑤的洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为 。
某化学兴趣小组测定某FeCl3样品(含少量FeCl2杂质)中铁元素的质量分数,实验室按以下步骤进行:
① 称量a g样品,置于烧杯中;
② 加入适量盐酸和适量蒸馏水,使样品溶解,然后准确配制成250mL溶液;
③ 准确量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水使反应完全;
④ 趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体全部由红褐色变为红棕色后,在干燥器中冷却至室温后,称量;
⑦ 重复以上操作,至最后两次称得的质量不超过0.1g为止。
请根据上面叙述,回答:
(1)下图所示仪器中,本实验步骤①②③中必须用到的仪器是E、F和 (填字母)。
(2)步骤②加入盐酸的目的是 ;加快样品溶解的最简单操作是 。
(3)写出步骤③中发生反应的离子方程式 。
(4)步骤⑤的洗涤是洗去附着在沉淀上的 (写离子符号),洗涤沉淀的操作 。
(5)若坩埚质量是W1,坩埚与加热后固体总质量是W2,则样品中铁元素的质量分数为 。
(13分)某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂,从下列固体物质中选取:
a. NH4HCO3 b. NH4Cl c. Ca(OH)2 d. NaOH
![]()
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是 (填代表备选试剂的字母);此时A中主要的玻璃仪器有 (填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式: 。
(3)对于C中发生的可逆反应,下列说法正确的 。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4:5
d. 使用铂丝网可以使正反应速率增大,同时也增大逆反应速率
(4)请在如图坐标中画出C装置中反应发生过程中的能量变化示意图(具体能量数值不用标出),并在虚线上分别标出反应物和生成物的化学式。
(5)待实验结束后,将B中固体混合物溶于500 mL 1 mol·L-1 的盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是 mol,甲在标准状况下体积为 L(忽略气体溶解)。
(16分)某化学兴趣小组用铜和浓硫酸制取SO2,并依次检验SO2具有酸性氧化物的性质和还原性、漂白性、氧化性,所用仪器如下图所示(图中连接胶管、夹持和加热装置省略): ☆
查阅资料可知,HSO-3 的酸性强弱与H2CO3相近。请回答下列问题:
(1)上述装置的接口连接顺序依次是 (填导管接口字母)。
(2)装置A、D中发生反应的化学方程式是:A , D 。
(3)证明SO2具有氧化性的现象是 ;证明SO2具有还原性的实验中,反应的离子方程式是 。
(4)C试管中NaOH溶液的作用是 ,CCl4的作用是 。
(5)实验过程中还观察到A试管内产生黑色沉淀,查资料可知,该黑色沉淀是副反应产生的CuS和Cu2S。收集黑色沉淀经过滤、洗净、干燥后放入氧气流中加热,然后冷却,用电子天平称重发现黑色固体质量减少a %,则a值范围是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com