
题目列表(包括答案和解析)
( 1 ) (4分)在实验室鉴定氯酸钾晶体和1-氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加入NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水过滤后取滤液;⑥过滤后取残渣;⑦用HNO3酸化。
鉴定氯酸钾中氯元素的操作步骤依次是_______________ (填序号)
鉴定1-氯丙烷中氯元素的操作步骤依次是_____________ (填序号)
( 2 ) (11分)通常用燃烧的方法测定有机物的的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。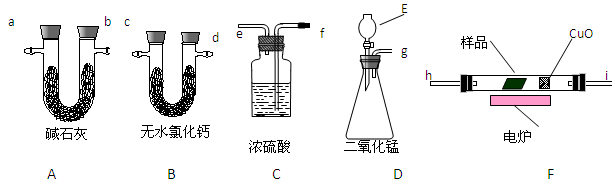
现准确称取1.8g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重1.76g,
B 管增重0.36g。请回答:
(1)该有机物的的最简式为__________________;
(2)产生的气体由左向右流向,所选用的各导管口连接的顺序是____________;
(3)E中应盛装什么试剂:_______________;
(4)如果把CuO网去掉,A管重量将_____________;(填“增大”、“减小”、或“不变”)
(5)A、B管内均盛有有固态试剂,B管的作用是______________________;
(6)要确定该有机物的分子式,还必须知道的数据是___________;
A. 消耗液体E的质量 B. 样品的摩尔质量 C. CuO固体减少的质量
D. C装置增加的质量 E. 燃烧消耗O2的物质的量
(7)在整个实验开始之前,需先让D产生的气体通过整套装置一段时间,其目的是
__________________________________________________。
( 1 ) (4分)在实验室鉴定氯酸钾晶体和1-氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加入NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水过滤后取滤液;⑥过滤后取残渣;⑦用HNO3酸化。
鉴定氯酸钾中氯元素的操作步骤依次是_______________ (填序号)
鉴定1-氯丙烷中氯元素的操作步骤依次是_____________ (填序号)
( 2 ) (11分)通常用燃烧的方法测定有机物的的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
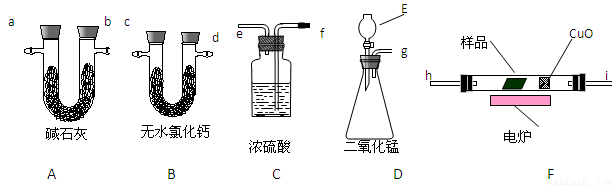
现准确称取1.8g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重1.76g,
B 管增重0.36g。请回答:
(1)该有机物的的最简式为__________________;
(2)产生的气体由左向右流向,所选用的各导管口连接的顺序是____________;
(3)E中应盛装什么试剂:_______________;
(4)如果把CuO网去掉,A管重量将_____________;(填“增大”、“减小”、或“不变”)
(5)A、B管内均盛有有固态试剂,B管的作用是______________________;
(6)要确定该有机物的分子式,还必须知道的数据是___________;
A. 消耗液体E的质量 B. 样品的摩尔质量 C. CuO固体减少的质量
D. C装置增加的质量 E. 燃烧消耗O2的物质的量
(7)在整个实验开始之前,需先让D产生的气体通过整套装置一段时间,其目的是
__________________________________________________。
(10分)(1) 氨是氮循环中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H-H键能为436KJ·mol-1,N≡N键能为945 KJ·mol-1,N-H键能为391 KJ·mol-1。写出合成氨反应的热化学方程式:
(2)可逆反应N2 +3H2 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
①单位时问内生成n mo1 N2的同时生成3n mol H2
②单位时间内1个N≡N键断裂的同时,有6个N—H键断裂[来源:Z.xx.k.Com]
③容器中N2、H2、NH3的物质的量为1:3:2
④常温下,混合气体的密度不再改变的状态
⑤常温下,混合气体的平均相对分子质量不再改变的状态
(3)恒温下,往一个2L的密闭容器中充入2.6 mol H2和1 mol N2,反应过程中对NH3的浓度进行检测,得到的数据如下表所:
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
C(NH3)/mol·L-1 |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,消耗N2的平均反应速率为 ;此条件下该反应的化学平衡常数K= ;反应达到平衡后,若往平衡体系中加入H2、N2和NH3各2mol,化学平衡将向 (填“正反应”或“逆反应”)方向移动。
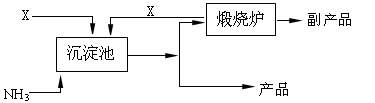
(4)氨是氮肥工业的重要原料。某化肥厂以天然石膏矿(主要成分CaSO4)为原料生产铵态氮肥(NH4)2SO4,(已知Ksp(CaSO4)=7.10×10-5 Ksp(CaCO3)=4.96×10-9)其工艺流程如下:

请写出制备(NH4)2SO4的反应方程式: ;
并利用有关数据简述上述反应能发生的原因
 2NH3 在恒容密闭容器中进行,达到平衡状态的标志是
2NH3 在恒容密闭容器中进行,达到平衡状态的标志是 | 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com