
题目列表(包括答案和解析)
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________.
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
(2)该反应达到平衡时若缩小体积,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
(3)该条件下反应__________________(填“能”或“不能”)自发进行.
(4)在如图中画出在某时刻条件改变后的图象(其他条件不变).
t1:增大NO的浓度
t2:降低温度

(12分)汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K)。
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________。
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
(2)该反应达到平衡时若增大压强,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”)。
(3)在如图中画出在某时刻条件改变后的图象(其他条件不变),在_______时间段CO的转化率最大。
t1:增大NO的浓度 t2:降低温度
(4)通过计算判断该条件下反应能否自发进行。
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________.
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
(2)该反应达到平衡时若缩小体积,则混合气体的平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
(3)该条件下反应__________________(填“能”或“不能”)自发进行.
(4)在如图中画出在某时刻条件改变后的图象(其他条件不变).
t1:增大NO的浓度
t2:降低温度
(5分)汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1,ΔS=-145 J·(mol·K)-1.
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
(2)若升高温度,则该反应的平衡常数 (填“增大”、“减小”或“不变”).
(3)判断该条件下反应 (填能、不能)自发.
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒 气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________.
| A.加催化剂同时升高温度 |
B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 |
| D.降低温度同时增大压强 |
 平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).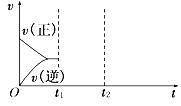
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com