
题目列表(包括答案和解析)
Ⅰ.请同学们认真并仔细地观察下面两种电池的构造示意图,回答下列问题:

(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O![]() 2MnOOH+Zn(OH)2,则负极的电极反应式为________.
2MnOOH+Zn(OH)2,则负极的电极反应式为________.
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大.试从影响反应速率的因素分析其原因是________.
Ⅱ.设计电池是原电池原理的重要应用.现有如下两个反应:
(A)NaOH+HCl![]() NaCl+H2O
NaCl+H2O
(B)2FeCl3+Cu![]() 2FeCl2+CuCl2
2FeCl2+CuCl2
(1)根据两个反应的本质,判断能否设计成原电池(A)________(填“能”或“否”,下同),(B)________.
(2)如果不能,说明其原因:________.
(3)如果可以,装置可采用烧杯和盐桥,请画出原电池的装置图并注明正、负极材料.
迄今为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。
I.请仔细观察下列两种电池的构造示意图,完成下列问题:
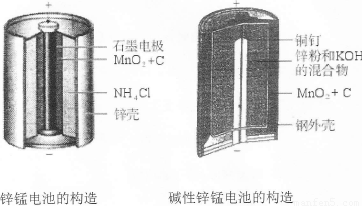
(1)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是 。
(2)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式为 。
Ⅱ.下面是一个将化学能与电能相互转化的装置。回答下列问题:
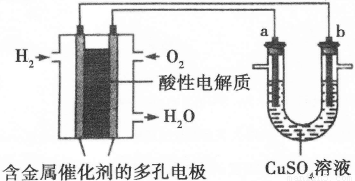
(1)写出通入O2一极的电极反应方程式为 。
(2)a电极是 极,能否写出其电极反应方程式 (填“能”或“不能”),若“能”写出其电极反应方程式,若“不能”说明其理由 。
(3)下列说法不正确的是( )
A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变
B.U型管中,OH—在a极放电
C.若a为纯净金属,b为粗制金属,该装置可用于粗制金属的精炼
D.电子经导线流入b电极
Ⅲ.某同学运用所学知识,自选材料设计实验,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下面框中画出能够实验这一反应的装置图,并在图中进行必要的标注。

迄今为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。
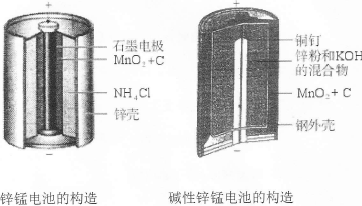
I.请仔细观察下列两种电池的构造示意图,完成下列问题:
(1)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是 。
(2)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式为 。
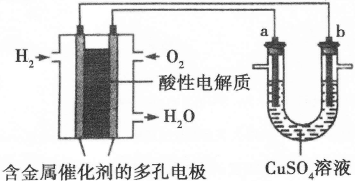
Ⅱ.下面是一个将化学能与电能相互转化的装置。回答下列问题:
(1)写出通入O2一极的电极反应方程式为 。
(2)a电极是 极,能否写出其电极反应方程式 (填“能”或“不能”),若“能”写出其电极反应方程式,若“不能”说明其理由 。
(3)下列说法不正确的是( )
| A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 |
| B.U型管中,OH—在a极放电 |
| C.若a为纯净金属,b为粗制金属,该装置可用于粗制金属的精炼 |
| D.电子经导线流入b电极 |

| A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 |
| B.U型管中,OH—在a极放电 |
| C.若a为纯净金属,b为粗制金属,该装置可用于粗制金属的精炼 |
| D.电子经导线流入b电极 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com