
题目列表(包括答案和解析)
(8分)在某温度下,将![]() 和
和![]() 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定![]() 的变化,5S时测定
的变化,5S时测定![]() =0.0080mol/L并保护不变。
=0.0080mol/L并保护不变。
(1)反应在达到平衡过程中,![]() 的平均消耗速率为 mol/L·S;
的平均消耗速率为 mol/L·S;
(2)反应的平衡常数的表达式是![]() = ;
= ;
(3)此温度下,平衡常数值为 ;
(4)若在此温度下,在10L的密闭器充入0.2molHI气体,达到平衡时,HI的转化率为 。
(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-→ NO+2H2O;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_______________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是______________________。
(8分)现有室温的①HCl ②H2SO4 ③CH3COOH三种溶液。
(1)若三种酸均为pH=2的溶液,它们的物质的量浓度由大到小的顺序是___________(用序号表示,下同),三种酸溶液各取1mL,分别加水到1000mL,pH最小的是________。
(2)若三种酸均为0.1mol·L-1的溶液,它们的pH由大到小的顺序是________,三种酸溶液各取1mL,分别加水稀释到1000mL,pH最小的是_________。
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.乙炔是有机合成工业的一种原料。工业上曾用![]() 与水反应生成乙炔。
与水反应生成乙炔。
(1) ![]() 中
中![]() 与
与![]() 互为等电子体,
互为等电子体,![]() 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol ![]() 中含有的
中含有的![]() 键数目为 。
键数目为 。
(2)将乙炔通入![]() 溶液生成
溶液生成![]() 红棕色沉淀。
红棕色沉淀。![]() 基态核外电子排布式为 。
基态核外电子排布式为 。
(3)乙炔与氢氰酸反应可得丙烯腈![]() 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
(4) ![]() 晶体的晶胞结构与
晶体的晶胞结构与![]() 晶体相似(如图所示),但
晶体相似(如图所示),但![]() 晶体中含有的中哑铃形
晶体中含有的中哑铃形![]() 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。![]() 晶体中1个
晶体中1个![]() 周围距离最近的
周围距离最近的![]() 数目为 。
数目为 。

B.对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。

一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在![]() 溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3,溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(l)上述实验中过滤的目的是 。
(2) 滤液在分液漏斗中洗涤静置后,有机层处于 层(填“上”或'下”);放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有 。
(3) 下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
| 催化剂 | n(催化剂) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
| n(甲苯) | 对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | ||
| 浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
| 1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
| NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
| 0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
| 0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
| 0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为 。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是 。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_ 、 。
(8分)中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~50%。
(1)有效“减碳”的手段之一是节能,下列制氢方法最节能的是
A.电解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O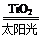 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O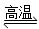 CO+3H2
CO+3H2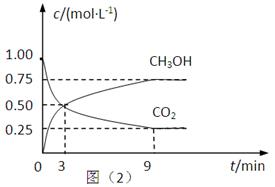
(2)CO2可转化成有机物实现碳循环。在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1,测得CO2和CH3OH(g)的浓度随时间变化如上图所示。
①从3 min到9 min,v(H2)=________mol·L-1·min-1。
②能说明上述反应达到平衡状态的是____________(填编号)。
A.反应中CO2与CH3OH的物质的量浓度之比为1∶1(即图中交叉点)
B.混合气体的密度不随时间的变化而变化
C.单位时间内消耗3mol H2,同时生成1mol H2O
D.CO2的体积分数在混合气体中保持不变
(3)工业上,CH3OH也可由CO和H2合成。参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数:
CH3OH(g)的平衡常数:
| 温度/℃ | 0 | 100 | 200 | 300 | 400 |
| 平衡常数 | 667 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com