III. 向A中加入适量3%的H
2O
2溶液,充分振荡后滤出沉淀,洗净、干燥、灼烧后,测得其质量为1.6 g。
根据上述实验回答下列问题:
(1) 实验I中,要检验FeSO
4溶液中是否含有Fe
3+常用的试剂是_______,“一系列操作”依次为_______、_______和过滤。
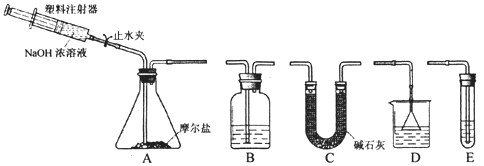
(2) 实验II中,选择的装置是A接_______接_______(填代号),A装置中未使用分液漏斗的理由是______________
(3) 向锥形瓶中加入NaOH溶液的操作方法是_______,吸收A中产生的气体所用试剂应是_______ .实验小组的同学为保证A中产生的气体被完全吸收,以准确测量其质量,他们在A中反应停止后再进行的操作是______________。
(4) 根据上述实验数据计算,7.84g摩尔盐中SO
42-的质量为_______g,摩尔盐中
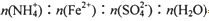
=_______

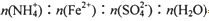 =_______
=_______