
题目列表(包括答案和解析)
已知某浓度的硫酸在水中的电离方程式:
H2SO4====H++HSO-4,![]()
![]() H++
H++![]() 。
。
(1)Na2SO4溶液显________(填“酸性”“碱性”或“中性”),理由是(用离子方程式表示)_________。
(2)在25 ℃时0.1 mol·L-1的NaHSO4溶液中c(![]() )=0.029 mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c(
)=0.029 mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c(![]() )________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
)________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
(3)在0.1 mol ·L-1 Na2SO4溶液中,下列粒子浓度关系正确的是( )
A.c(Na+)+c(H+)=c(OH-)+c(HSO-4)+2c(![]() )
)
B.2c (Na+)=c(![]() )+c(HSO-4)
)+c(HSO-4)
C.c(Na+)>c(![]() )>c (H+)>c (OH-)
)>c (H+)>c (OH-)
D.c(![]() )+c(HSO-4)=0.1 mol·L-1
)+c(HSO-4)=0.1 mol·L-1

 H++
H++ 。
。 )="0.029" mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c(
)="0.029" mol ·L-1,则25 ℃时,0.1 mol·L-1 H2SO4溶液中c( )________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
)________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。A.c(Na+)+c(H+)=c(OH-)+c(HSO-4)+2c( ) ) |
B.2c (Na+)=c( )+c(HSO-4) )+c(HSO-4) |
C.c(Na+)>c( )>c (H+)>c (OH-) )>c (H+)>c (OH-) |
D.c( )+c(HSO-4)="0.1" mol·L-1 )+c(HSO-4)="0.1" mol·L-1 |
H2SO4![]() H++
H++![]() ,
,![]()
![]() H++
H++![]() 。
。
(1)Na2SO4溶液显________(填“酸性”“碱性”或“中性”),理由是(用离子方程式表示)_________。
(2)在![]() )=0.029 mol ·L-1,则
)=0.029 mol ·L-1,则![]() )________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
)________(填“大于”,“小于”或“等于”)0.029 mol ·L-1,理由是__________。
(3)在0.1 mol ·L-1 Na2SO4溶液中,下列粒子浓度关系正确的是( )
A.c(Na+)+c(H+)=c(![]() )+
)+![]() )
)
B![]() )+c(
)+c(![]() )
)
C.c(Na+)>c(![]() )>c (H+)>c (OH-)
)>c (H+)>c (OH-)
D.c(![]() )+c(
)+c(![]() )=0.1 mol·L-1
)=0.1 mol·L-1
酸、碱、盐是化学工作者研究的重要领域,请回答下列各小题:(1)某二元酸H2X的电离方程式是:H2X=H++HX—,HX— X2—+H+。回答下列问题:
X2—+H+。回答下列问题:
①KHX溶液显 (填“酸性”、“碱性”或“中性”)。
②若0.1 mol·L—1KHX溶液的pH=2,则0.1 mol·L—1H2X溶液中氢离子的物质的量
浓度 (填“<”、“>”或“=”)0.11 mol·L—1,理由是 。
③0.01 mol·L—1的HCl与0.02 mol·L—1的KHX溶液等体积混合液中各离子浓度由大到小的顺序是
 (2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成
(填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39
mol4·L—4,KsP[Al(OH)3]=1.3×10—33
mol4·L—4。
(2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成
(填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39
mol4·L—4,KsP[Al(OH)3]=1.3×10—33
mol4·L—4。
(3)在25℃下,有pH=3的醋酸溶液和pH=11的氢氧化钠溶液,其中氢氧化钠溶液的物质的量浓度是 ,醋酸溶液的物质的量浓度 (填“>”、“<”、“=”)氢氧化钠溶液物质的量浓度。将上述两溶液等体积混合,反应后溶液显 (填“酸”、“碱”、“中”)性。
(4)某强酸性反应体系中,发生反应:
X+ PbO2+ H2SO4 = Pb(MnO4)2+ PbSO4+ H2O ,
已知X是一种硫酸盐,且0.2 mol X在该反应中失去1 mol 电子,则X的化学式是
。请将上述化学方程式配平,把系数填在各物质前的横线上。.
酸、碱、盐是化学工作者研究的重要领域,请回答下列各小题:(1)某二元酸H2X的电离方程式是:H2X=H++HX—,HX—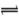 X2—+H+。回答下列问题:
X2—+H+。回答下列问题:
①KHX溶液显 (填“酸性”、“碱性”或“中性”)。
②若0.1 mol·L—1KHX溶液的pH=2,则0.1 mol·L—1H2X溶液中氢离子的物质的量
浓度 (填“<”、“>”或“=”)0.11 mol·L—1,理由是 。
③0.01 mol·L—1的HCl与0.02 mol·L—1的KHX溶液等体积混合液中各离子浓度由大到小的顺序是  (2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成 (填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(2)在25℃下,向浓度均为0.1 mol·L—1的FeCl3和AlCl3混合溶液中逐滴加入氨水,先生成 (填化学式)沉淀。已知25℃时Ksp[Fe(OH)3]=2.6×10—39 mol4·L—4,KsP[Al(OH)3]=1.3×10—33 mol4·L—4。
(3)在25℃下,有pH=3的醋酸溶液和pH=11的氢氧化钠溶液,其中氢氧化钠溶液的物质的量浓度是 ,醋酸溶液的物质的量浓度 (填“>”、“<”、“=”)氢氧化钠溶液物质的量浓度。将上述两溶液等体积混合,反应后溶液显 (填“酸”、“碱”、“中”)性。
(4)某强酸性反应体系中,发生反应:
X+ PbO2+ H2SO4 = Pb(MnO4)2+ PbSO4+ H2O ,
已知X是一种硫酸盐,且0.2 mol X在该反应中失去1 mol 电子,则X的化学式是
。请将上述化学方程式配平,把系数填在各物质前的横线上。.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com