
题目列表(包括答案和解析)
每空2分,共12分)化学反应可为人类提供能量
(Ⅰ)家用液化气的主要成分之一是丁烷(C4H10),常温常压下,当5.8 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2.9×105kJ,试写出丁烷燃烧的热化学方程式:____________________________________________,已知1mol液态水气化时需要吸收44 kJ的热量,则反应: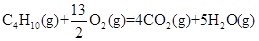 的ΔH为____________________。
的ΔH为____________________。
(Ⅱ)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述情况判断:
(1)蓄电池的负极是______,其电极反应式为______________________________。
(2)蓄电池的正极电极反应式为_________________________________。
(3)蓄电池工作时,其中电解质溶液的pH______(填“增大”、“减小”或“不变”)。
每空2分,共12分)化学反应可为人类提供能量
(Ⅰ)家用液化气的主要成分之一是丁烷(C4H10),常温常压下,当5.8 kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为2.9×105kJ,试写出丁烷燃烧的热化学方程式:____________________________________________,已知1mol液态水气化时需要吸收44 kJ的热量,则反应:
 的ΔH为____________________。
的ΔH为____________________。
(Ⅱ)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸。工作时,该电池的总反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据上述情况判断:
(1)蓄电池的负极是______,其电极反应式为______________________________。
(2)蓄电池的正极电极反应式为_________________________________。
(3)蓄电池工作时,其中电解质溶液的pH______(填“增大”、“减小”或“不变”)。
(每空2分,共12分)下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格: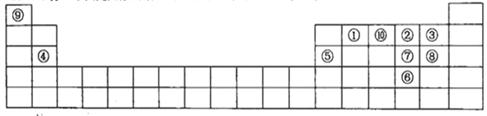
(1)在这10种元素中,非金属性最强的是___________(填序号);
(2)元素②⑧⑨以原子个数比1:1:1形成的化合物的结构式为______________________,元素②与⑨形成的18e-化合物的电子式____________________;
(3)②、⑨、⑩三种元素形成的化合物M中原子个数比为3:4:2,电子总数为42,M中含有的化学键类型有___________________________;
(4)比较元素⑦⑧形成的气态氢化物的稳定性:____>____(用化学式表示)
(5)元素⑤的氧化物与氢氧化钠溶液反应的离子方程式______________________。
 的ΔH为____________________。
的ΔH为____________________。(每空2分,共12分)某校化学研究性学习小组的同学在学习了金属的知识后,为了解Cu的常见化合物性质,运用类比学习的思想提出![]() 如下的问题,探究。请你协助该小组的同学完成下列研究。
如下的问题,探究。请你协助该小组的同学完成下列研究。
【提出问题】
①Cu的金属活泼性小于Al,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?③CuO能被H2、CO等还原,也![]() 能被NH3还原吗?
能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有:CuSO4溶液、_________(填试剂),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量A的质量为72g。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器还有红色固体存在。据些可推得,A的化学式为_____。
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):

实验中观察到CuO变为红色物质,无水CuSO4变____色。同时生成一种对大气无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性,证明Cu(OH)2具有两性的实验现象应是____________________________________。
(2)根据“实验方案(2)”,得出的+1价Cu和+2价Cu稳定性大小的结论是__________________________________。
【问题讨论】
(1)有同学认为NH3与CuO反应生成的![]() 红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质
红色物质是Cu,也有同学认为NH3与CuO反应生成的红色物质![]() 是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A______________________________________________________。
是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应中生成的红色物质中是否含有A______________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com