(2010?信阳二模)I.一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验.某研究性学习小组在实验室中配制1mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液.下列有关说法中正确的是
ABD
ABD
A.实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B.如果实验中需用60mL的稀硫酸标准溶液,配制时应选用100mL容量瓶;
C.容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E.用甲基橙作指示剂,滴定终点时,溶液颜色从橙色变为红色;
F.配制溶液和中和滴定的两个实验中,若在最后一次读数均俯视读数,则导致实验结果都偏大.
Ⅱ.现用如图1所示的装置制取较多量的饱和氯水并测定饱和氯水的pH.回答有关问题:
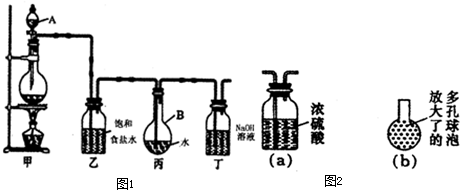
(1)写出有关化学方程式.
装置甲:
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
;
装置丁:
2NaOH+Cl2=NaCl+NaClO+H2O
2NaOH+Cl2=NaCl+NaClO+H2O
.
(2)证明氯水已饱和的现象是
丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体
丙中的导管有气泡溢出水面,且液面上方充满黄绿色气体
(3)制取结束时,装置丙的液体中含有的微粒是
Cl2、H2O、HClO、H+、Cl-、OH-、ClO-
Cl2、H2O、HClO、H+、Cl-、OH-、ClO-
(用微粒符号表示)
(4)有如下改进措施或建议,请作出评价:
①在装置乙和丙之间增加如图2(a)所示的装置,你认为有无必要?
无
无
.
②在装置丙的长导管下口处,接如图2(b)所示的多孔球泡,这样做的好处是:
增加氯气与水的接触面积,吸收更充分
增加氯气与水的接触面积,吸收更充分
③若撤去装置乙,直接将装置甲和丙相连.这样做对实验结果的影响是:
使测定的pH减小
使测定的pH减小
.





 Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.
Ⅰ.甲、乙两种元素是同一短周期的相邻元素,乙元素的原子是同周期元素中未成对p电子数最多的,甲元素有多种同素异形体,其中一种能导电.