
题目列表(包括答案和解析)

(1)下列有关实验操作或判断不正确的是________(填有关序号,选错倒扣分).
A、用10mL量筒量取稀硫酸溶液8.0mL
B、用干燥的pH试纸测定氯水的pH
C、用碱式滴定管量取KMnO4溶液19.60mL
D、使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度偏大
E、圆底烧瓶、锥形瓶、蒸发皿加热时都应垫在石棉网上
F、测定硫酸铜晶体中结晶水含量时,将加热后的坩埚置于干燥器中冷却后再称量
G.用冰醋酸,蒸馏水和容量瓶等仪器配制pH为1的醋酸稀溶液
(2)实验室利用如右图装置进行中和热的测定.

回答下列问题:
①该图中有两处未画出,它们是________、________;
②如果用0.5mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将(填“偏大”、“偏小”或“不变”);原因是________.
(3)在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
2MnO4-+5C2O42-+16H+![]() 2Mn2++10CO2↑+8H2O
2Mn2++10CO2↑+8H2O
①用托盘天平称取WgNa2C2O4晶体.
②将WgNa2C2O4配成100mL标准溶液,移取20.00mL置于锥形瓶中,则酸性KMnO4溶液应装在________(填“酸式”或“碱式”)滴定管中.
③若滴定管的起始读数和终点读数如图所示,则酸性KMnO4的物质的量浓度为________(填表达式).
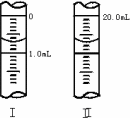
④若滴定完毕立即读数,测定的KMnO4溶液的浓度________(填“偏高”“偏低”或“不变”).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com