
题目列表(包括答案和解析)
汽车为推动人类文明、生活方便舒适起着重要作用,但同时也恶化了自然生态环境。汽车每年排放的一氧化碳、碳氢化合物、一氧化氮等有害气体占大气污染总量的60%以上。
(1)一氧化氮与一氧化碳都是汽车尾气中的有害气体,它们在催化转换器中能反应氮气和二氧化碳,对此反应,下列说法中正确的是( )
A.使用催化剂不能加大反应速率 B.升高温度能加大反应速率
C.改变压强对反应速率没有影响 D.降低压强能加大反应速率
(2)假设辛烷气对空气的体积之比(在相同条件下)为a,要使辛烷完全燃烧,amax是 。
(3)①若辛烷气对空气的体积之比大于amax,2mol辛烷燃烧生成的有害气体的含量为xmol时,其反应的化学方程式为 。
②当辛烷气对空气体积之比小于amax时,则尾气所污染大气的有害气体增多的是 ,产生此气体的化为方程式为 。
II、食盐中含有碘酸钾。
已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32―=2I-+S4O62-。
(1)若检验食盐中所含碘酸钾,可利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验生成的碘时,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量:
a.称取a g食盐并加蒸馏水使其完全溶解;
b.将所得溶液用稀硫酸酸化,再加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,用1.0×10-3mol/L Na2S2O3溶液进行滴定,当消耗20.0mLNa2S2O3溶液时达到滴定终点。则加碘食盐样品中的碘元素含量是 mg/kg(以含a的代数式表示)。
(3)若向食盐溶液中加入淀粉溶液和KI溶液,振荡。溶液无变化。然后再滴入1滴稀H2SO4,振荡,溶液变蓝色
①用离子方程式表示实验中产生蓝色现象的可能原因 。
②根据此实验结果,请对(2)的实验结果作出简要评价: 。(填“偏大”或“偏小”)
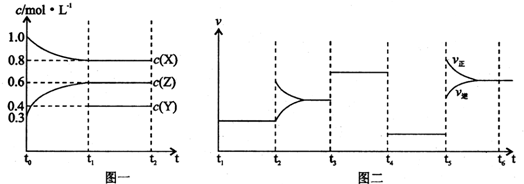
| A、Y的起始物质的量为1.0 mol | ||||
| B、t4-t5阶段改变的条件为减小压强;t5-t6是升高温度 | ||||
| C、此温度下该反应的化学方程式为2X(g)+Y(g)?2Z(g) | ||||
D、在相同条件下,若起始时容器中加入a mol X b mol Y和c mol Z,要达到t1时刻同样的平衡,a,b,c要满足的条件为a+
|
| A、6 ml | B、6.5 ml | C、7 ml | D、7.5 ml |
 3Z(g)△H<O
3Z(g)△H<O| c3(z) |
| c(x)?c2(y) |
| c3(z) |
| c(x)?c2(y) |
| A、在相同条件下,焓变小于0而熵变大于0的反应肯定能自发进行 | B、升高温度会加快化学反应速率,其原因是增加了活化分子的百分数 | C、青石棉的化学式为Na2Fe3Si8O22(OH)2,用氧化物的形式可表示为:Na2O?3FeO?Fe2O3?8SiO2?H2O | D、红外光谱法可以确定物质相对分子质量 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com