
题目列表(包括答案和解析)
(12分)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制500 mL、0.2 mol·L-1的稀硫酸。可供选择的仪器有:①玻璃棒 ②烧瓶 ③烧杯 ④胶头滴管 ⑤量筒 ⑥容量瓶 ⑦托盘天平 ⑧药匙。请回答下列问题:
(1)上述仪器中,在配制稀硫酸时用不到的有 (填代号)。
(2)经计算,需浓硫酸的体积为  mL(保留一位小数);
mL(保留一位小数);
现有①10 mL ②50 mL ③100 m L三种规格的量筒,你选用的量筒是 。(填代号)
L三种规格的量筒,你选用的量筒是 。(填代号)
(3)将浓硫酸加适量蒸馏水稀释后,冷却片刻,随后全部转移到 mL的容量瓶中,转移时应用玻璃棒 。转移完毕,用少量蒸馏水洗涤烧杯和 2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近瓶颈刻度 cm处,改用 滴加蒸馏水到凹液面的最低点与刻度线相切。塞上瓶塞、摇匀后,把溶液倒入试剂瓶、贴上标签。
(4)定容时,俯视刻度线,所配溶液的物质的量浓度将 (选填“偏高”、“偏 低”或“不变”)。
低”或“不变”)。
(12分)实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取w g该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。回答下列问题: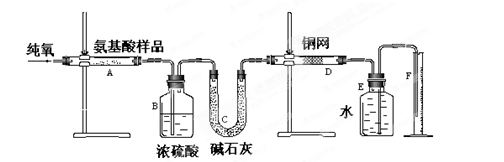
(1)实验开始时,首先通入一段时间的氧气,其理由是_ ;
(2)以上装置中需要加热的仪器有______(填写字母),操作时应先点燃________处的酒精灯。
(3)A装置中发生反应的化学方程式是__________________ ___________________。
(4)D装置的作用是 。
(5)实验中测得氮气的体积为V mL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有_ __。
| A.生成二氧化碳气体的质量 | B.生成水的质量 |
| C.通入氧气的体积 | D.氨基酸的相对分子质量 |
(12分)(1)已知离子反应: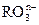 +6I—+6H+=R—+3I2+3H2O,n= ,R元素在
+6I—+6H+=R—+3I2+3H2O,n= ,R元素在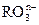 中的化合价是 。
中的化合价是 。
(2)化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该种有害物质。例如: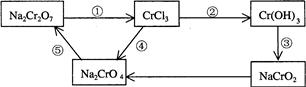
① 在上述有编号的步骤中,需用氧化剂的是 (填编号)。
②完成并配平下列反应的化学方程式,按要求标出电子转移的方向和数目,并回答问题:
__Na2Cr2O7+__KI+__HCl——__CrCl3+_NaCl+__KCl+__I2+ (用单线桥表示电子转移的方向、数目)
(用单线桥表示电子转移的方向、数目)
当反应中有3mol电子转移时,氧化产物的质量是 。
(12分)(1)在硫酸工业生产中,我国采用黄铁矿为原料 生产SO2,反应的化学方程式为: ,该反应在 中进行。
(2)为了有利于SO2的转化为SO3,且能充分利用热能,采 用 了多层催化剂间有热交换器的接触室(见图)。按此密闭体系中气体的流向,则C处流出的气体为 ,A、B、C三处气体的温度由高到低的顺序为 。

(3)在吸收塔中用 吸收SO3,从吸收塔上部导出的气体再次通入 ,进行第二次氧化,再进行一次吸收后将尾气中很少的SO2净化回收,以防污染大气。
(12分)实验室有一瓶密封不严的漂白粉, 请利用以下仪器和试剂,完成该漂白粉成分的探究。试管、滴管、带导管的单孔塞、蒸馏水、自来水、1mol/LHCl、品红溶液、新制澄清石灰水。
(1) 提出假设:假设一:该漂白粉未变质, 含________________________。
假设二:该漂白粉全部变质,含________________________。
假设三:该漂白粉部分变质,含CaCl2, Ca(ClO)2 ,CaCO3
(2)进行实验:在答题卡上完成下表(不必检验Ca2+、Cl-)
|
| 实验步骤 | 预期现象和结论 |
| ① | 用A试管取少量澄清石灰水备用,用B试管取少量样品,再向B试管加入________________
| 若无气体放出且澄清石灰水未见浑浊,则假设________成立: |
| ② |
|
|
| ③ |
|
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com