
题目列表(包括答案和解析)

某温度下,相同pH的硫酸和硫酸铵溶液中水电离出来的c(H+)分别是1.0×10-a mol?L-1和1.0×10-bmol?L-1,在此温度下,则下列说法正确的是( )
A.a<b B.a=b
C.水的离子积为1.0×10-(7+a) D.水的离子积为1.0×10-(b+a)
(15分)
在常温下,某水溶液M中。
(1)若M中存在的离子只有:Na+、CH3COO-、H+、OH-,下列关系合理的是 。
① c(Na+)>c(CH3COO-)>c(OH-)>c(H+) ② c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
③ c(H+)>c(OH-)>c(Na+)>c(CH3COO-) ④ c(Na+)=c(CH3COO-)且c(OH-)=c(H+)
(2)若M由两种相同物质的量浓度的溶液混合而成,其中只存在OH—、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH—)>c(H+),这两种溶液的溶质是 。
(3)若M为0.01 mol/L的氨水,向其中加入等体积pH=2的盐酸溶液(忽略溶液体积变化),所得混合液中:c(NH4+)+c(H+)-c(OH-)= 。
(4)若M为20 mL稀硫酸和盐酸混合液,向该混合酸溶液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如图所示,当加入60 mLBa(OH)2溶液时,C点溶液的pH=7(忽略溶液体积变化),试计算:
(i)最初混合酸溶液中c(H2SO4)=__________,c(HCl)=____________。
(ii)B点溶液的pH为多少?(写出计算过程。可能用到的数据:1g2=0.30、1g3=0.48)
工业制硫酸时,利用催化氧化反应将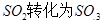 是一个关键的步骤。
是一个关键的步骤。
(1)某温度下,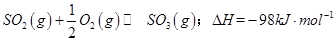 。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
。开始时在100L的密闭容器中加入4.0molSO2(g)和10.0molO2,当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=____________。
(2)一定条件下,向一带活塞的密闭容器中充入2mol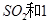 mol
mol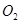 ,发生反应:
,发生反应: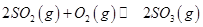 ,达平衡后改变下述条件,
,达平衡后改变下述条件,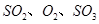 气体平衡浓度都比原来增大的是____________(填字母)。
气体平衡浓度都比原来增大的是____________(填字母)。
A.保持温度和容器体积不变,充入2mol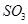 |
| B.保持温度和容器体积不变,充入2molN2 |
C.保持温度和容器内压强不变,充入1mol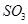 |
| D.移动活塞压缩气体 |
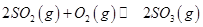 反应的图像中,不正确的是_________。
反应的图像中,不正确的是_________。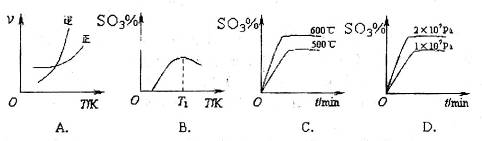
 的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。
的硫酸溶液,当电解过程共转移了0.1mol电子时,理论上消耗SO2的体积为(标准状况)为_________,此溶液的pH="__________" (忽略溶液体积变化)。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com