
题目列表(包括答案和解析)
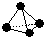
(1)A中盛有的固体深色试剂a是__________,分液漏斗中试剂b是__________。
(2)B中盛有液体c是__________,C中的液体d是__________。
(3)D中所发生反应的化学方程式是__________。
(4)E中的保温瓶中盛有致冷剂,它应是__________(在“干冰”“冰水”“液态空气”中选择)在E的内管得到的氧化二氯中可能含有的杂质是__________。
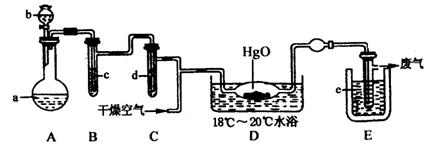
(5)装置A、B、C间的连接方式与D、E间的连接方式有明显的区别,这区别是__________,用这些不同的连接方式的主要理由是__________。
 ,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:______________________。
,已知断裂1 mol B—B键吸收167 kJ的热量,生成1 mol B≡B键放出942 kJ热量。试判断相同条件下B4与B2的稳定性顺序是:______________________。
 (3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是___________________。
(3)由B、C两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构。X遇水蒸气可形成一种常见的漂白性物质。则X与水反应的化学方程式是___________________。


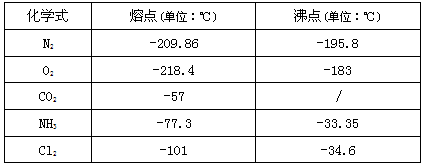
已知:A、B、C、D、E、F、X为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上的未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同;X的基态原子的价电子排布式为3d84s2.
请回答下列问题:
(1)B、C、D三种元素的电负性由大到小的顺序是 (填元素符号)。
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的分子式为 。(写出2种即)
(3)与C同族、且位于第四周期元素所形成气态化物的电子式为 ,它属于 (填“极性”或“非极性”)分子,其沸点低于C的氢化物的沸点,主要原因是 。
(4)F的基态原子核外电子排布式是 。
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能 (填“大”或“小”)。
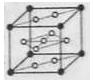
(6)氢气是理想的清洁能源,X元素与镧(La)元素的合金可做储氢材料,该合金的晶胞如右图所示,晶胞中心有一个X原子,其他X原子都在晶胞面上,则该晶体的化学式为 。已知该晶体的密度为![]() ,其摩尔质量为
,其摩尔质量为![]() ,则该晶胞的体积是 。(请列出算式)
,则该晶胞的体积是 。(请列出算式)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com