
题目列表(包括答案和解析)
下图是元素周期表的框架
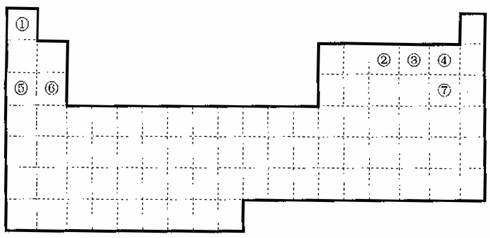
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)依据元素周期表回答下列问题:
A.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(用化学式表示)。
B.周期中表的元素④和元素⑦的氢化物的熔、沸点高低顺序是
(用化学式表示)。
C.①―⑦元素的某单质有常温下化学性质稳定,通常可以保护气的是
(用化学式表示)。
D.在上面元素周期表中全部是金属元素的主族是 ;全部是非金属元素的主族是 (填写离母a、b、c、d)。
a.IA族 b.ⅡA族 c.ⅣA族 d.VIIA族
 (3)已知甲元素位于第三周期,且其原子半径为同周期金属元素中的原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 ;在一定条件下1g①的单质在足量③的单质中完全燃烧生成液态物质时,放出的热量为akJ,请写出此条件下表示①的单质燃烧的热化学方程式 ;
(3)已知甲元素位于第三周期,且其原子半径为同周期金属元素中的原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 ;在一定条件下1g①的单质在足量③的单质中完全燃烧生成液态物质时,放出的热量为akJ,请写出此条件下表示①的单质燃烧的热化学方程式 ;
①、③两种元素的单质已被应用于宇宙飞船的燃料电池中,如图所示,两个电极均由多孔性碳构成,通入的两种单质由孔隙逸出并在电极表面放电。
请回答:b是电池的 极;a电极上的电极反应式是 。
下图是元素周期表的一部分,表中的①~⑩各代表一种元素,用元素符号或化学式填空回答:
|
周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的原子的结构示意图为 。
(2)地壳中含量最多的金属元素是 。(填元素符号)
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的物质是 ,碱性最强的物质是 ,呈两性的氢氧化物是 。(填化学式)
(4)写出⑤的单质与氢氧化钠溶液反应的化学方程式 。
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式 。
(5)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L。则HXR的相对分子质量为 ;HXR的化学式为 。
下图为元素周期表的一部分,根据元素①~⑧在周期表中的位置,按要求回答下列问题。
| 族 周期 | IA | | 0 | |||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | | | | | | ② | ③ | |
| 3 | ④ | ⑤ | | | | ⑥ | ⑦ | ⑧ |
| | 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | ||||
| 第一组 | 1 | 40 | FeCl3溶液 | 快速产生大量气泡 | 相同条件下,温度升高,化学反应速率加快 |
| 2 | 20 | A | 缓慢产生适量气泡 | ||
| 3 | 5 | FeCl3溶液 | 缓慢产生极少量气泡 | ||
| 第二组 | 4 | t | MnO2 | 快速产生大量气泡 | |
| 5 | 20 | 无 | 缓慢产生极少量气泡 | ||
| 族 周期 | IA | | 0 | |||||
| 1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
| 2 | | | | | | ② | ③ | |
| 3 | ④ | ⑤ | | | | ⑥ | ⑦ | ⑧ |
| | 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | ||||
| 第一组 | 1 | 40 | FeCl3溶液 | 快速产生大量气泡 | 相同条件下,温度升高,化学反应速率加快 |
| 2 | 20 | A | 缓慢产生适量气泡 | ||
| 3 | 5 | FeCl3溶液 | 缓慢产生极少量气泡 | ||
| 第二组 | 4 | t | MnO2 | 快速产生大量气泡 | |
| 5 | 20 | 无 | 缓慢产生极少量气泡 | ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com