
题目列表(包括答案和解析)
1,2,3,4—四氢化萘的结构简式是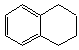 ,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2
,分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+4Br2![]() C10H8Br4+4HBr。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
C10H8Br4+4HBr。生成的四溴化萘常温下为固态,不溶于水。有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。
②慢慢滴入液溴,不断搅拌,直到反应完全。
③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。
④分液,得到的“水层”即氢溴酸溶液。
回答下列问题:
(1)下面示意图中的装置,适合步骤①和②操作的是 。
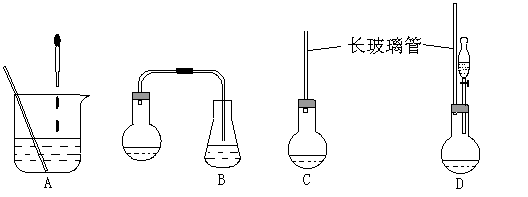
(2)步骤②中如何判断“反应完全” 。
(3)步骤③中补充少量四氢化萘的目的是 。
(4)步骤③中过滤后得到的固体物质是 。
(5)已知在实验条件下,饱和氢溴酸水溶液中氢溴酸的质量分数是66%,如果溴化反
应进行完成,则步骤①中四氢化萘和水的质量比约是1︰ (保留小数点后1位)。
A.3:1 B.4:1 C.1:4 D.1:5
在反应KI + 5KIO3 + 3H2S O4== 3K2SO4 + 3I2 + 3H2O中,若有1.66 g KI、10.7 g KIO3和足量的H2S反应,则被氧化的碘元素和被还原的碘元素质量比为 ( )
A.3:1 B.4:1 C.1:4 D.1:5
A.3:1 B.4:1 C.1:4 D.1:5
A.0.40 mol 0.50 mol 0.12 mol
B.0.66 mol 0.50 mol 0.24 mol
C.0.64 mol 0.50 mol 0.24 mol
D.0.64 mol 0.02 mol 0.24 mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com