随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO
2)排放量减少8%,氮氧化物(NO
x)排放量减少10%.目前,消除大气污染有多种方法.
(1)处理NO
x的一种方法是利用甲烷催化还原NO
x.已知:
CH
4(g)+4NO
2(g)=4NO(g)+CO
2(g)+2H
2O(g)△H=-574kJ?mol
-1CH
4(g)+4NO(g)=2N
2(g)+CO
2(g)+2H
2O(g)△H=-1160kJ?mol
-1则甲烷直接将NO
2还原为N
2的热化学方程式为
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1
.
(2)全钒氧化还原液流电池,是目前发展势头强劲的优秀绿色环保储能电池.
其电池总反应为:V
3++VO
2++H
2O
VO
2++2H
++V
2+.充电过程中,H
+向
阴极区
阴极区
迁移(填“阴极区”或“阳极区”).充电时阴极反应式为
V3++e-=V2+
V3++e-=V2+
.
(3)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g)?N
2(g)+2CO
2(g);△H<0.
该反应的化学平衡常数表达式为K=
.

若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,反应过程中各物质的浓度变化如图所示.若保持温度不变,20min时再向容器中充入CO、N
2各0.6mol,平衡将
不
不
移动(填“向左”、“向右或“不”).20min时,若改变反应条件,导致N
2浓度发生如图所示的变化,则改变的条件可能是
②
②
(填序号).
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO
2的量
(4)利用Fe
2+、Fe
3+的催化作用,常温下将SO
2转化为SO
42-而实现SO
2的处理(总反应为2SO
2+O
2+2H
2O=2H
2SO
4).已知,含SO
2的废气通入含Fe
2+、Fe
3+的溶液时,其中一个反应的离子方程式为4Fe
2++O
2+4H
+=4Fe
3++2H
2O,则另一反应的离子方程式为
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
.

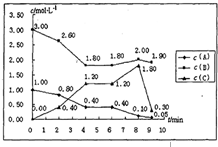 在一个容积固定为1L的密闭容器中,发生反应mA(g)+nB(g)═pC(g)△H=?.反应情况如下图所示:
在一个容积固定为1L的密闭容器中,发生反应mA(g)+nB(g)═pC(g)△H=?.反应情况如下图所示:
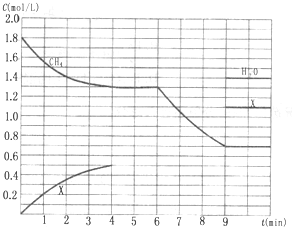 向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
向反应体系中同时通入甲烷、氧气和水蒸气,发生的主要化学反应有: