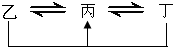
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L
-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
(1)写出化合物甲的电子式:
.
(2)写出化合物甲的水溶液与D元素对应的金属阳离子反应的离子方程式
3NH3?H2O+Al3+=Al(OH)3↓+3NH4+
3NH3?H2O+Al3+=Al(OH)3↓+3NH4+
;写出均含有F元素的乙与丁在溶液中发生反应的离子方程式
Fe+2Fe3+=3Fe2+
Fe+2Fe3+=3Fe2+
.
(3)由A、C元素组成的化合物戊和A、E元素组成的化合物己,式量均为34.其中戊的熔沸点高于己,其原因是:
H2O2分子间存在氢键
H2O2分子间存在氢键
.
(4)复盐是指由2种或2种以上阳离子和一种酸根离子组成的盐.请写出由A、B、C、E、F元素组成的一种具有还原性的复盐庚的化学式
NH4)2Fe(SO4)2或(NH4)2Fe(SO4)2?6H2O或(NH4)2SO4?FeSO4?6H2O
NH4)2Fe(SO4)2或(NH4)2Fe(SO4)2?6H2O或(NH4)2SO4?FeSO4?6H2O
.该复盐是一种重要的化学试剂,据中学课本介绍,工业上常用如下方法制取:将一定量的两种盐配成混合溶液,再加热浓缩混合溶液,冷却至室温则析出带有6个结晶水的该复盐晶体.写出相关反应的化学方程式
(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2?6H2O
(NH4)2SO4+FeSO4+6H2O=(NH4)2Fe(SO4)2?6H2O
,析出该复盐晶体的原理是
硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多
硫酸亚铁铵在水中溶解度比硫酸铵、硫酸亚铁在水中的溶解度要小得多
.

 A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去).
A、B、C、D是短周期元素形成的四种气体单质.E、F均为气体,且F为红棕色.有关的转化关系如图所示(反应条件均已略去).

 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH- C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.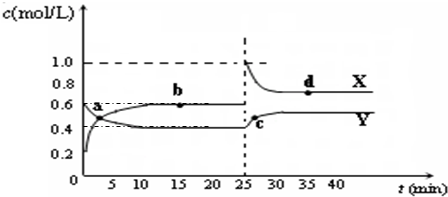
 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:

