
题目列表(包括答案和解析)
对于温度与反应方向的关系,下列判断一定不正确的是
A. △H<0 ,△S>0,所有温度下反应自发进行
B. △H<0 ,△S<0,低温下反应自发进行
C. △H>0 ,△S>0,所有温度下反应自发进行
D. △H>0 ,△S<0,所有温度下反应不能自发进行
|
对于温度与反应方向的关系,下列判断一定不正确的是 | |
| [ ] | |
A. |
ΔH<0,ΔS>0,所有温度下反应自发进行 |
B. |
ΔH<0,ΔS<0,低温下反应自发进行 |
C. |
ΔH>0,ΔS>0,所有温度下反应自发进行 |
D. |
ΔH>0,ΔS<0,所有温度下反应不能自发进行 |
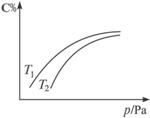
A.若正反应方向ΔH>0,则T1>T2
B.若压缩体积,混合气体的平均相对分子质量增大
C.B不一定为气体
D.A可能为气体
| t/℃ | 25 | 125 | 225 | … |
| K | 4.1×105 | K1 | K2 | … |
| 实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min) | |
| N2 | H2 | NH3 | |||
| 1 | 650 | 2 | 4 | 0.9 | 9 |
| 2 | 900 | 1 | 2 | 0.3 | 0.01 |
| t/℃ | 25 | 125 | 225 | … |
| K | 4.1×105 | K1 | K2 | … |
| 实验组 | 温度(℃) | 起始量(mol) | 平衡量(mol) | 达到平衡所需时间(min) | |
| N2 | H2 | NH3 | |||
| 1 | 650 | 2 | 4 | 0.9 | 9 |
| 2 | 900 | 1 | 2 | 0.3 | 0.01 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com