
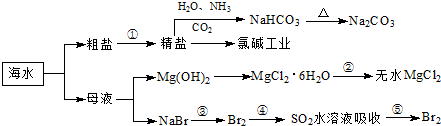
题目列表(包括答案和解析)
某学生利用中和滴定的原理设计如下实验用于测定混有纯碱的烧碱样品的纯度.
步骤1:称取一定量该烧碱样品,溶于水配成100.00 mL溶液;
步骤2:取20.00 mL该溶液,加入过量的BaCl2溶液充分反应;
步骤3:向上述悬浊液中滴入2滴酚酞试液,用标准HCl溶液滴定.
回答:(1)步骤3中如何判断滴定恰好进行完全?________________
(2)步骤3中未将沉淀滤出即进行滴定,是否会影响测定结果?________原因是________________.
(3)步骤3中滴定速度过快会导致测定结果________(填序号①偏高②偏低③无影响④无法确定).
(4)步骤3中能否用甲基橙代替酚酞?________原因是________(填序号①会引起测定结果偏高②会引起测定结果偏低③能够正确指示终点,不会引起误差).
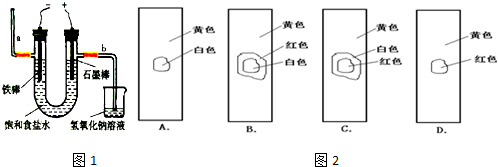
 某学生设计了如图所示的装置进行实验,各装置中所装试剂、实验操作及实验现象如下:
某学生设计了如图所示的装置进行实验,各装置中所装试剂、实验操作及实验现象如下:| △ |
| △ |
| ||

| ||
| ||
2- |
2- 3 |
2- 3 |
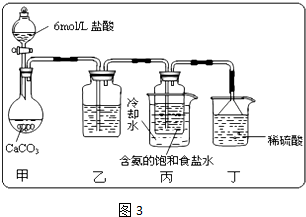
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | ----- |
| 步骤2: | |
| 步骤3: |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com