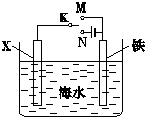
(1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
N
N
处.若X为锌,开关K置于M处,该电化学防护法称为
牺牲阳极的阴极保护法
牺牲阳极的阴极保护法
.
(2)肼(N
2H
4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料.肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液.该电池放电时,通入肼的一极为
负
负
极,该极的电极反应式是
N2H4+4OH--4e-=N2↑+4H2O
N2H4+4OH--4e-=N2↑+4H2O
,电池工作一段时间后,电解质溶液的pH将
减小
减小
(填“增大”、“减小”、“不变”).
(3)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO
3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,可通过电解制备碘酸钾.(阴、阳两极均用惰性电极,阴极室与阳极室用阳离子交换膜隔开)请回答下列问题:
①电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I
2+6KOH═5KI+KIO
3+3H
2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.电解时,阳极上发生反应的电极反应式为
2I--2e-=I2
2I--2e-=I2
.
②电解过程中,为确定电解是否完成,需检验电解液中是否有I
-.请设计一个检验电解液中是否有I
-的实验方案,并按要求填写下表.
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选.
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸.

 (1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
(1)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
 已知可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).进行如下操作:
已知可逆反应:AsO43-+2I-+2H+?AsO33-+I2+H2O据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).进行如下操作: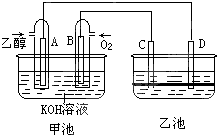 如图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
如图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性,请根据图示回答下列问题: