
题目列表(包括答案和解析)
(16分) 丁子香酚结构简式如图。丁子香酚的一种同分异构体:对-甲基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体。某校兴趣小组提出可以利用中学所学的简单有机物进行合成,A的产量标志着一个国家石油化工发展水平。其方案如下:


(1)写出丁香子酚的分子式 和含有的官能团名称
(2)指出化学反应类型:① ;②
(3)下列物质不能与丁香子酚发生反应的是 (填序号)
a.NaOH溶液 b.NaHCO3溶液 c.Br2的四氯化碳溶液 d.乙醇
(4)写出反应③的化学反应方程式
(5)写出符合i含有苯环;ii能够发生银镜反应的D的同分异构体:
(只答其中一种即可)
(16分)丁子香酚结构简式如图。丁子香酚的一种同分异构体:对-甲基苯甲酸乙酯(F)是有机化工原料,用于合成药物的中间体。某校兴趣小组提出可以利用中学所学的简单有机物进行合成,A的产量标志着一个国家石油化工发展水平。其方案如下: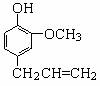

(1)写出丁香子酚的分子式 和含有的官能团名称
(2)指出化学反应类型:① ;②
(3)下列物质不能与丁香子酚发生反应的是 (填序号)
a.NaOH溶液 b.NaHCO3溶液 c.Br2的四氯化碳溶液 d.乙醇
(4)写出反应③的化学反应方程式
(5)写出符合i含有苯环;ii能够发生银镜反应的D的同分异构体:
(只答其中一种即可)
(16分)10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
A、Ba(OH)2溶液 B、BaCl2溶液 C、NaOH溶液 D、澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则
(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
(16分) 氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g)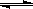 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)上述反应氧化剂是 ,已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的∆H = 。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是( )
A.焦炭的质量不再变化 B.N2 和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是( )
A.升高温度 B.降低压强 C.加入更多的SiO2 D.充入N2
(4)该反应的温度控制在1300-1700oC的原因是 。
(5)某温度下,测得该反应中N2和CO各个时刻的浓度如下,求0—20 min内N2的平均反应速率 ,该温度下,反应的平衡常数K= 。
|
时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
|
N2浓度/mol·L-1 |
4.00 |
3.70 |
3.50 |
3.36 |
3.26 |
3.18 |
3.10 |
3.00 |
3.00 |
3.00 |
|
CO浓度/mol·L-1 |
0.00 |
0.90 |
1.50 |
1.92 |
2.22 |
2.46 |
2.70 |
|
|
|
(每空2分,共16分)依据事实,填空:
(1)在25℃、101kPa下,1g甲醇液体完全燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_________________
(3)氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质的这种电池在使用时的电极反应式: 正极: ;负极:
(4)在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
| 物质 | X | Y | Z |
| 初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
该反应的反应方程式可表示为 ,平衡时Y气体的转化率 。
(5)某核素AZX的氯化物XCl2 1.11 g配成溶液后,需用1mol·L-1的硝酸银溶液20ml才能把氯离子完全沉淀下来。则X的质量数为 ;若X的核内中子数为20,则37 g XCl2中所含质子的物质的量 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com