
题目列表(包括答案和解析)
(7分)0.2 mol有机物和0.5 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6g。
(1)判断该有机物的化学式。
(2)若0.2 mol该有机物恰好与4.6 g金属钠完全反应,试确定该有机物的结构简式。
(7分)0.2 mol有机物和0.5 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。
(1)判断该有机物的化学式。
(2)若0.2 mol该有机物恰好与4.6 g金属钠完全反应,试确定该有机物的结构简式。
0.2 mol有机物和0.5 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g).产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g.
(1)判断该有机物的化学式.
(2)若0.2 mol该有机物恰好与4.6 g金属钠完全反应,试确定该有机物的结构简式.
0.2 mol有机物A和0.5 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O.产物经过浓H2SO4后,质量增加10.8 g;再通过灼热的CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,质量增加17.6 g.
(1)试推断该有机物的化学式.
(2)若0.2 mol该有机物恰好与4.6 g金属钠完全反应,试确定A的结构简式.
(3)试写出A的不与金属钠反应的同分异构体.
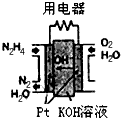
 N2O4(g) △H=-52.7kJ·mol-1
N2O4(g) △H=-52.7kJ·mol-1 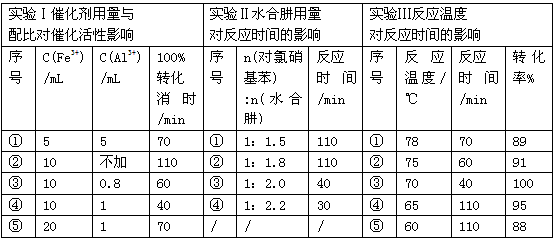
 N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)
N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)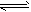 N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com