
题目列表(包括答案和解析)
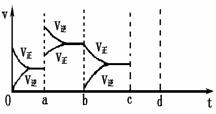 右图表示在密闭容器中反应:2SO2+O2
右图表示在密闭容器中反应:2SO2+O2![]() 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是 ;
bc过程中改变的条件可能是 ;
(2)(3分)已知下列两个热化学方程式:
H2(g)+![]() O2(g) = H2O( l ) △H=-285.8 kJ·mol-1
O2(g) = H2O( l ) △H=-285.8 kJ·mol-1
C3H8(g)+5O2(g) = 3CO2(g) +4H2O(l) △H=-2220.2 kJ·mol-1
实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热3847kJ,则混合气体中H2和C3H8的体积比是
(3)、(3分)实验室进行电解氯化钠溶液时,两极共收集到4.48L气体(标况),假设反应后溶液的总体积为200ml,则电解后溶液中氢氧化钠的物质的量浓度
在一定条件下,二氧化硫和氧气发生如下反应:2SO2+O2![]() 2SO3 ΔH<0。
2SO3 ΔH<0。
(1)写出该反应的化学平衡常数表达式:K=_____________________。
(2)降低温度,该反应K值________,二氧化硫的转化率________,化学反应速率________(以上均填“增大”“减小”或“不变”)。
(3)600 ℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3的物质的量变化如右图所示,反应处于平衡状态的时间是______________。

(4)据图判断,反应进行至20 min时,曲线发生变化的原因是______________(用文字表达),10 min~15 min的曲线变化的原因可能是______________(填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
(1)对于下列反应:2SO2 + O2 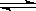 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
(2)右图表示在密闭容器中反应:2SO2+O2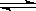 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,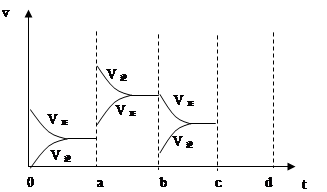
a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸: .
(1)对于下列反应:2SO2 + O2  2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。
(2)右图表示在密闭容器中反应:2SO2+O2 2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,
2SO3 △H<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,
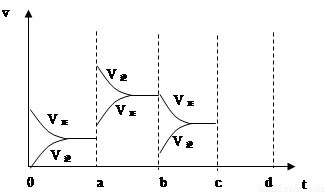
a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c~d处.
(3)请用化学平衡移动知识解释久置的氯水(尤其是长期放置在见光环境),最后浅绿色消失,溶液变成稀盐酸: .
(1)二氧化硫的催化氧化的过程如图所示,其中a、c二步的化学方程式可表示为:
 SO2+V2O5
SO2+V2O5![]() SO3+ V2O4
SO3+ V2O4
4VOSO4+O2![]() 2V2O5+4SO3。
2V2O5+4SO3。
 该反应的催化剂是 (写化学式)
该反应的催化剂是 (写化学式)
(2)550 ℃时,SO2转化为SO3的平衡转化率(α)与
体系总压强(p)的关系如右图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3![]() 2SO2+O2 在550 ℃时的平衡常数K= 。
2SO2+O2 在550 ℃时的平衡常数K= 。
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5L密闭容器中,反应达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是
A.升高温度 B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2 D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2![]() 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
试填写下列空格:ks5u
 A容器达到平衡时所需的时间比B容器__ _(填:“短”
A容器达到平衡时所需的时间比B容器__ _(填:“短”
或“长”);平衡时A容器中SO2的转化率比B容器_______(填:
“大”或“小”);达到所述平衡后,若向两容器中通入等物质的量的
原反应气体,达到平衡时,A容器的混合气体中SO3的体积分
数_________(填“增大”、“减小”或“不变”,下同);B容器的
混合气体中SO3的体积分数_________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com