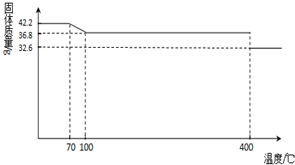
(2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K
4[Fe(CN)
6]?3H
2O.
42.2g K
4[Fe(CN)
6]?3H
2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示.试回答下列问题:
(1)试确定150℃时固体物质的化学式为
K4[Fe(CN)6]
K4[Fe(CN)6]
.
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN).据此判断,烹饪食品时应注意的问题为
应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃
应避免与醋、西红柿等酸性物质一起烹饪;控制烹饪温度不超过400℃
.
(3)在25℃下,将a mol?L
-1的KCN溶液与0.01mol?L
-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a
>
>
0.01mol?L
-1(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数K
a=
(100a-1)×10-7 mol?L-1
(100a-1)×10-7 mol?L-1
.
(4)在Fe
2+、Fe
3+的催化作用下,可实现2SO
2+O
2+2H
2O═2H
2SO
4的转化.已知,含SO
2的废气通入Fe
2+、Fe
3+的溶液时,其中一个反应的离子方程式为4Fe
2++O
2+4H
+═4Fe
3++2H
2O,则另一反应的离子方程式为
2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+
2Fe3++SO2+2H2 ═2Fe2++SO42-+4H+
.则上述转化的重要意义在于
变废为宝,消除污染
变废为宝,消除污染
.
(5)已知Fe(OH)
3的溶度积常数K
sp=1.1×10
-36.室温时在FeCl
3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe
3+是否沉淀完全
c(Fe3+)=1.1×10-3(mol/L)>10-5 mol?L-1故Fe3+没有沉淀完全
c(Fe3+)=1.1×10-3(mol/L)>10-5 mol?L-1故Fe3+没有沉淀完全
.(提示:当某离子浓度小于10
-5 mol?L
-1时可以认为该离子沉淀完全了)

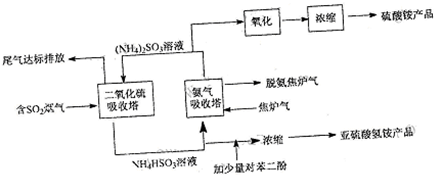
 (2010?崇文区二模)面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径.
(2010?崇文区二模)面对全球近期的气候异常,环境问题再次成为焦点.SO2、NOx、CO2是对环境影响较大的气体,对他们的合理控制和治理是优化我们生存环境的有效途径. (2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.
(2013?德州模拟)食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6]?3H2O.
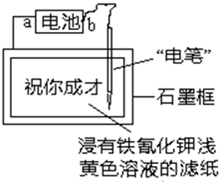 (2011?安庆三模)已知:含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀.现用如图装置在浸有铁氰化钾浅黄色溶液的滤纸上写出特征蓝色的字“祝你成才”.据此判断下列说法正确的是( )
(2011?安庆三模)已知:含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀.现用如图装置在浸有铁氰化钾浅黄色溶液的滤纸上写出特征蓝色的字“祝你成才”.据此判断下列说法正确的是( )