
题目列表(包括答案和解析)
已知反应:3I-(aq)+S2O![]() (aq)
(aq)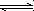 I
I![]() (aq)+2SO
(aq)+2SO![]() (aq)
(aq)
(1)写出反应的平衡常数表达式K=________;
(2)下图表示反应过程中有关物质的能量,则反应的ΔH________0(填“>”、“<”或“=”);
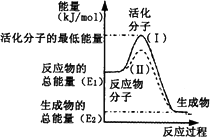
(Ⅰ)、(Ⅱ)两线中,使用催化剂的是________线;
(3)反应中发生反应的I-与被氧化的I-的物质的量比为________;
(4)反应的速率可以用I![]() 与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,记录的数据如下:
与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,记录的数据如下:
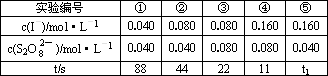
则:该实验的目的是________,显色时间t1=________分析表中数据,得出的结论是________.
 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.- 4 |
- 4 |
2- 4 |
2- 8 |
2- 8 |
+ 4 |
+ 4 |
|
已知 Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O | |
| [ ] | |
A. |
O2 和S2O |
B. |
每生成 1 mol Fe3O4,则转移电子数为2 mol |
C. |
参加反应的氧化剂与还原剂的物质的最之比为1∶1 |
D. |
若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol |
|
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O | |
| [ ] | |
A. |
O2和S2O |
B. |
每生成1 mol Fe3O4,则转移电子数为2 mol |
C. |
参加反应的氧化剂与还原剂的物质的最之比为1∶1 |
D. |
若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol |
|
已知Fe3O4可表示成(FeO·Fe2O3),水热法制备Fe3O4纳米颗粒的总反应为:3Fe2++2S2O | |
| [ ] | |
A. |
O2和S2O |
B. |
每生成1 mol Fe3O4,则转移电子数为2 mol |
C. |
参加反应的氧化剂与还原剂的物质的最之比为1∶1 |
D. |
若有2 mol Fe2+被氧化,则被Fe2+还原的O2为0.5 mol |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com