(2011?天津模拟)某中学化学课外活动小组欲探究铁在氯气中燃烧产物的成份、性质和用途,设计了如下实验步骤:
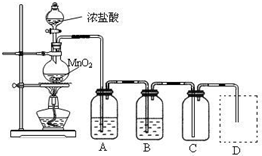
Ⅰ.用下列实验装置制取纯净干燥的氯气
写出A、B中所盛放最佳化学试剂的名称
饱和食盐水
饱和食盐水
、
浓硫酸
浓硫酸
,画出虚线框内所需装置图并标明所需试剂的名称
.
Ⅱ.某同学将一定量铁粉与Cl
2恰好完全反应得到一固体物质a,然后通过实验确定其成分.探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设①:该固体物质是FeCl
3;假设②:
FeCl2
FeCl2
;假设③:
FeCl3和FeCl2的混合物
FeCl3和FeCl2的混合物
.
(2)设计实验方案:
取少量固体物质a于烧杯中,加适量水溶解,然后取两份a溶液分别进行实验,实验现象与结论如下表,请在表格内的横线处填空.
| 实验方法 |
实验现象 |
结论 |
在溶液中加
KSCN溶液 |
溶液为红色 溶液为红色 |
固体物质中有FeCl3 |
向a溶液中滴加
酸性KMnO4溶液 |
KMnO4溶液紫色
不褪色 |
固体物质中不含固体物质中不含 FeCl2 固体物质中不含 FeCl2 |
由此得出结论:假设
①
①
成立(填序号①②③).
Ⅲ.为进一步探究物质a的性质,他们又利用a溶液做了如下一些实验,其中现象、结论均正确的是
AD
AD
(填写序号)
A.向氢氧化镁悬浊液中滴加a溶液出现红褐色沉淀,证明K
sp[Fe(OH)
3]<K
sp[Mg(OH)
2]
B.向a溶液中加入少量铁粉,铁粉溶解,溶液颜色由浅绿色变成黄色
C.向沸水中滴加a的饱和溶液,立即出现红褐色沉淀
D.将a溶液加热蒸干并灼烧,得到Fe
2O
3固体
IV.a溶液常作印刷电路铜板的腐蚀剂,写出发生反应的离子方程式
2Fe3++Cu2+=2Fe3++Cu
2Fe3++Cu2+=2Fe3++Cu
.活动小组的同学们又设计了两种从上述废液中回收Cu的方案:
方案1:设计流程图如下:
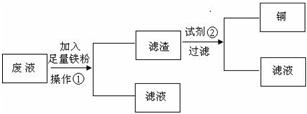
请分别写出操作①和试剂②的名称
过滤
过滤
,
盐酸(或稀硫酸)
盐酸(或稀硫酸)
.
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解,铜作
阴
阴
极.当观察到阴极有少量气泡产生时,停止电解,这时要回收的Cu已全部析出.
评价:方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为:
有污染性气体Cl2产生;使用了电解装置,成本较高等
有污染性气体Cl2产生;使用了电解装置,成本较高等
.




