
题目列表(包括答案和解析)
在1支大试管中收集1/5体积的甲烷和4/5体积的氯气,将其倒置于饱和食盐水中,放在光亮的地方,经过一段时间后可观察到混合气的颜色___________,试管中液面___________,试管内壁附着___________。写出有关反应方程式_________________________________。

(1)加2 mL水及小火加热的原因___________________________________________________。
(2)若忽略加2 mI水及小火加热,将会产生红棕色蒸气,写出产生红棕色蒸气的方程式___________________________________________________________________。
(3)在U形管中收集到的溴乙烷呈红褐色,原因是___________________________________。
(4)净化溴乙烷的方法是__________________________________________________________。
| 物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O已知下列数据:
|
物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
|
乙醇 |
-144 |
78 |
0.789 |
|
乙酸 |
16.6 |
117.9 |
1.05 |
|
乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
|
浓H2SO4 |
|
338 |
1.84 |
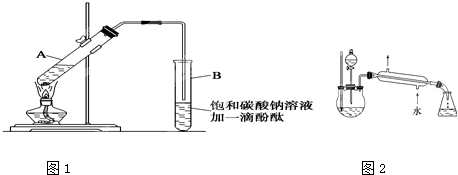
实验室制乙酸乙酯的主要装置如下图(a)所示,主要步骤为:
①在30mL的大试管中按体积比1:4:4的比例配制浓硫酸、乙醇和乙酸的混合液;
②按(a)图连接装置,使产生的蒸气经导管通到15ml试管所盛饱和Na2CO3溶液(加入1滴酚酞试液)上方2mm~3mm处;
③小火加热试管中的混合液;
④待小试管中收集到约4mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层;
⑤分离出纯净的乙酸乙酯。
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的操作是
(2)写出该反应的化学方程式________,浓H2SO4的作用是________。
(3)步骤③中,用小火加热试管中的混合液,其原因是________。
(4)步骤④所观察到的现象是________,写出原因与结论:________。
(5)步骤⑤中,分离出乙酸乙酯选用的仪器是________,产物应从________口倒出,因为________。
(6)为提高乙酸乙酯的产率,甲、乙两位同学分别设计了如上图甲、乙的装置(乙同学待反应完毕冷却后再用饱和Na2CO3溶液提取烧瓶中产物)。你认为哪种装置合理,为什么?答________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com