二甲醚(CH
3OCH
3)是无色气体,可作为一种新型能源.由合成气(组成为H
2、CO和少量的CO
2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(Ⅰ)CO(g)+2H
2(g)═CH
3OH(g)△H
1=-90.1kJ?mol
-1(Ⅱ)CO
2(g)+3H
2(g)═CH
3OH(g)+H
2O(g)△H
2=-49.0kJ?mol
-1水煤气变换反应:
(Ⅲ)CO(g)+H
2O(g)═CO
2(g)+H
2 (g)△H
3=-41.1kJ?mol
-1二甲醚合成反应:
(Ⅳ)2CH
3OH(g)═CH
3OCH
3(g)+H
2O(g)△H
4=-24.5kJ?mol
-1回答下列问题:
(1)Al
2O
3是合成气直接制备二甲醚反应催化剂的主要成分之一.工业上从铝土矿制备较高纯度Al
2O
3的主要工艺流程是
Al
2O
3(铝土矿)+2NaOH+3H
2O=2NaAl(OH)
4,NaAl(OH)
4+CO
2=Al(OH)
3↓+NaHCO
3,2Al(OH)
3Al
2O
3+3H
2O
Al
2O
3(铝土矿)+2NaOH+3H
2O=2NaAl(OH)
4,NaAl(OH)
4+CO
2=Al(OH)
3↓+NaHCO
3,2Al(OH)
3Al
2O
3+3H
2O
(以化学方程式表示).
(2)分析二甲醚合成反应(Ⅳ)对于CO转化率的影响
消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO
消耗甲醇,促进甲醇合成反应(Ⅰ)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(Ⅲ)消耗部分CO
.
(3)由H
2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为
2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1
2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1
.根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响
该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大
该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,CH3OCH3产率增加.压强升高使CO和H2浓度增加,反应速率增大
.
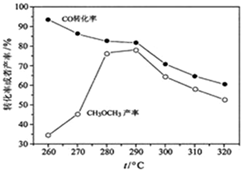
(4)有研究者在催化剂(含Cu-Zn-Al-O和Al
2O
3)、压强为5.0MPa的条件下,由H
2和CO直接制备二甲醚,结果如图所示.其中CO转化率随温度升高而降低的原因是
反应放热,温度升高,平衡左移
反应放热,温度升高,平衡左移
.
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93kW?h?kg
-1).若电解质为酸性,二甲醚直接燃料电池的负极反应为
CH3OCH3+3H2O=2CO2+12H++12e-
CH3OCH3+3H2O=2CO2+12H++12e-
,一个二甲醚分子经过电化学氧化,可以产生
12
12
个电子的能量;该电池的理论输出电压为1.20V,能量密度E=
(列式计算.能量密度=电池输出电能/燃料质量,1kW?h=3.6×10
6J).



 二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源.由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应: