
题目列表(包括答案和解析)
| ||
实验室可用NaNO2+NH4Cl =NaCl+N2↑+2H2O制备N2,下列说法正确的是
A.NaNO2发生氧化反应
B.NH4Cl中的氮元素被还原
C.N2既是氧化产物,又是还原产物
D.每生成1mol N2转移电子的物质的量为6mol
 NaCl+N2↑+2H2O制备N2,下列说法正确的是
NaCl+N2↑+2H2O制备N2,下列说法正确的是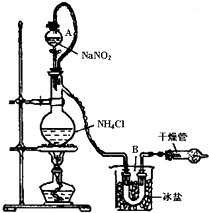 氯化铵是一种重要的化工原料,应用广泛.
氯化铵是一种重要的化工原料,应用广泛.
| ||
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com