
题目列表(包括答案和解析)
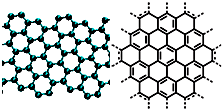 A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:
A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:

A.反应由逆反应开始
B.表示有催化剂,b表示无催化剂
C.若n=2,其他条件相同,a比b的压强大
D.若其他条件相同,a比b的温度高
为除去下表所列物质含有的少量杂质(括号内为杂质),在A项中选择试剂,在B项中选择操作的方法,将其代号填入表中:
A:(1)NaCl细颗粒; (2)NaOH溶液; (3)水; (4)CaO;
(5)饱和Na2CO3; (6)溴水; (7)KMnO4溶液。
B:(1)过滤; (2)盐析; (3)蒸馏; (4)分液; (5)结晶;
(6)洗气; (7)渗析
|
物质 |
蛋 白 质溶液 (氯化钠溶液) |
乙 烷 (乙烯) |
肥 皂 (甘油) |
乙醇(水) |
乙酸乙酯(乙酸) |
溴苯(溴) |
|
加入试剂 |
|
|
|
|
|
|
|
操作方法 |
|
|
|
|
|
|
为除去下表所列物质含有的少量杂质(括号内为杂质),在A项中选择试剂,在B项中选择操作的方法,将其代号填入表中:
A:(1)NaCl细颗粒; (2)NaOH溶液; (3)水; (4)CaO;
(5)饱和Na2CO3; (6)溴水; (7)KMnO4溶液。
B:(1)过滤; (2)盐析; (3)蒸馏; (4)分液; (5)结晶;
(6)洗气; (7)渗析
| 物质 | 蛋 白 质溶液 (氯化钠溶液) | 乙 烷 (乙烯) | 肥 皂 (甘油) | 乙醇(水) | 乙酸乙酯(乙酸) | 溴苯(溴) |
| 加入试剂 |
|
|
|
|
|
|
| 操作方法 |
|
|
|
|
|
|
(10分)车祸严重危害了司乘人员的生命安全,为了降低车祸给司乘人员所带来的损害,有人利用化学反应在小汽车前排设计了一气袋。气袋由固体化合物A+B+C组成,在汽车受到撞击的一刹那,由于剧烈碰撞,导致气袋里发生化学反应,气袋迅速膨胀,随及弹出,从而保护司乘人员的头颈不致于撞到钢架、挡风玻璃,该气袋已挽救了成千上万人的生命。
化合物A为白色固体,通常情况下相对稳定,碰撞时剧烈分解,产生熔融状态的D与气体E。D常温下为固体,性质十分活跃,直接与O2作用生成F,F为黄色粉末,可用做高空飞行或潜水时的供氧剂。气体E十分稳定,但可与金属锂作用生成白色固体G,G强烈水解,生成易溶于水的化合物H与气体I,H与气体I的水溶液均为碱性。
化合物B为钾盐,无色晶体,易溶于水,其溶解度随温度升高急剧增大。B加热时易分解,生成固体J与气体K,气体K可使带有余烬的火柴复燃。
化合物C为氧化物,无色、坚硬、不溶于水,在自然界中以原子型晶体存在,能与HF气体作用生成L与气体氟化物M。
4-1 判断A、B、C为何种化合物?
4-2 分析A、B两种盐阴离子杂化方式及成键情况,并画出示意图。
4-3 写出剧烈碰撞后,气袋中所发生的化学反应。
4-4 固体C在气袋里起到什么作用?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com