
题目列表(包括答案和解析)
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。x为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT2+的电子式 ,基态Z原子的核外电子排布式为 。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有 (写两条)。
(3)ET2的空间构型为 ,为 分子(填“极性”或“非极性”)
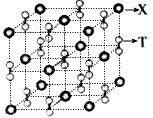
(4)化合物甲由T、X两元素组成,高温下,化合物甲晶体呈立方体结构,其晶胞如图,甲的化学式为 。晶体中氧的化合价部分为0价,部分为-2价,则下列说法正确的是 ( )

A.每个晶胞中含有14个心和13个O2-
B.晶体中每个K+周围有8个O2-,每O2-周围有8个K+
C.晶体中与每个K距离最近的K+有8个
D.晶体中,O价氧原子与-2价氧原子的数目比为3:l
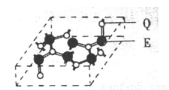
(5)化合物乙的晶胞如图,乙由E、Q两元素组成,硬度超过金刚石。则乙的晶体中E、Q两种元素原子的杂化方式均为 。
| 有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。X为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号) (1)写出QT2+的电子式___________,基态Z原子的核外电子排布式为___________。 (2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有______________________(写两条)。 (3)ET2的空间构型为___________,为___________分子(填“极性”或“非极性”) (4)化合物甲由T、X两元素组成,高温下,化合物甲晶体呈立方体结构,其晶胞如图,甲的化学式为 ____________。晶体中氧的化合价部分为0价,部分为-2价,则下列说法正确的是____________ |
 |
| A.每个晶胞中含有14个心和13个O2- B.晶体中每个K+周围有8个O2-,每O2-周围有8个K+ C.晶体中与每个K距离最近的K+有8个 D.晶体中,O价氧原子与-2价氧原子的数目比为3:l (5)化合物乙的晶胞如图,乙由E、Q两元素组成,硬度超过金刚石。则乙的晶体中E、Q两种元素原子的杂化方式均为_________________。 |
 |
有E、Q、T、X、Z五种前四周期元素,原子序数E<Q<T<X<Z。E、Q、T三种元素的基态原子具有相同的能层和能级,且I1(E)<I1(T)<I1(Q),其中基态Q原子的2p轨道处于半充满状态,且QT2+与ET2互为等电子体。x为周期表前四周期中电负性最小的元素,Z的原子序数为28。请回答下列问题(答题时如需表示具体元素,请用相应的元素符号):
(1)写出QT2+的电子式 ,基态Z原子的核外电子排布式为 。
(2)Q的简单氢化物极易溶于T的简单氢化物,其主要原因有 (写两条)。
(3)ET2的空间构型为 ,为 分子(填“极性”或“非极性”)
(4)化合物甲由T、X两元素组成,高温下,化合物甲晶体呈立方体结构,其晶胞如图,甲的化学式为 。晶体中氧的化合价部分为0价,部分为-2价,则下列说法正确的是 ( )
A.每个晶胞中含有14个心和13个O2-
B.晶体中每个K+周围有8个O2-,每O2-周围有8个K+
C.晶体中与每个K距离最近的K+有8个
D.晶体中,O价氧原子与-2价氧原子的数目比为3:l
(5)化合物乙的晶胞如图,乙由E、Q两元素组成,硬度超过金刚石。则乙的晶体中E、Q两种元素原子的杂化方式均为 。
| A.极性键 | B.非极性键 | C.离子键 | D.配位键 E.氢键 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com