
题目列表(包括答案和解析)
选做题
从以下两道题中任选一道做。
1.光催化制氢是化学研究的热点之一。科学家利用含有吡啶环(吡啶的结构式为![]() ,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):
,其性质类似于苯)的化合物Ⅱ作为中间体,实现了循环法制氢,示意图如下(仅列出部分反应条件):

(1)化合物Ⅱ的分子式为________________________________________。
(2)化合物Ⅰ合成方法如下(反应条件略,除化合物Ⅲ的结构未标明外,反应式已配平):
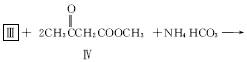
![]()
化合物Ⅲ的名称是_______________________。
(3)用化合物Ⅴ(结构式见下图)代替Ⅲ作原料,也能进行类似的上述反应,所得有机产物的结构式为____________________。

(4)下列说法正确的是________________(填字母)。
A.化合物Ⅴ的名称是间羟基苯甲醛,或2羟基苯甲醛
B.化合物Ⅰ具有还原性;Ⅱ具有氧化性,但能被酸性高锰酸钾溶液氧化
C.化合物Ⅰ、Ⅱ、Ⅳ都可发生水解反应
D.化合物Ⅴ遇三氯化铁显色,还可发生氧化反应,但不能发生还原反应
(5)吡啶甲酸酯可作为金属离子的萃取剂。2吡啶甲酸正丁酯(Ⅵ)的结构式见下图,其合成原料2吡啶甲酸的结构式为__________________;Ⅵ的同分异构体中,吡啶环上只有一个氢原子被取代的吡啶甲酸酯类同分异构体有____________________种。

Ⅵ
2.铜单质及其化合物在很多领域有重要用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为_____________________。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为________。

(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下:

下列说法正确的是_________________(填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是_____________________。
(5)Cu2O的熔点比Cu2S的______________(填“高”或“低”),请解释原因____________________________。
@@1. (1)C11H13NO4 (2)甲醛
(3)
(4)BC
(5)![]() 12
12
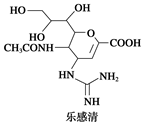
Ⅰ.2009年墨西哥、美国等地出现甲型H1N1流感疫情,引起全世界的关注,这种流感疫情是由甲型H1N1病毒引起的。美国疾病控制和预防中心推荐使用瑞士罗氏制药公司生产的“达菲”胶囊和英国葛兰素—史克公司生产的喷雾式药剂“乐感清”两款药物。
达菲和乐感清的结构简式如下图所示:

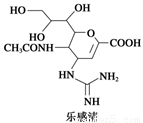
请回答下列问题:
(1)乐感清的分子式是____ 。
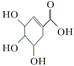
(2)合成达菲的主要原料莽草酸(结构简式为 
 )存在于我国盛产的八角茴香中。关于莽草酸性质的描述,下列说法正确的是( )
)存在于我国盛产的八角茴香中。关于莽草酸性质的描述,下列说法正确的是( )
A. 1 mol莽草酸与足量的金属钠反应可生成4mol H2。
B. 1 mol莽草酸与足量氢氧化钠溶液反应,最多可消耗氢氧化钠4 mol。
C. 1 mol莽草酸与足量的碳酸钠溶液反应可生成二氧化碳气体1 mol。
D. 1 mol莽草酸与足量的碳酸氢钠溶液反应可生成二氧化碳气体1 mol
(3)下列每组中各有三对物质,它们都能用分液漏斗分离的是
A.乙酸乙酯和水,酒精和水,植物油和水
B.四氯化碳和水,溴苯和水,硝基苯和水
C.甘油和水,乙酸和水,乙酸和乙醇
D.汽油和水,苯和水,乙二醇和水
Ⅱ.下图中A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物。请回答下列问题:

(1)C分子中官能团的名称是 ;化合物B不能发生的反应是 (填字母序号)。
a.加成反应 b.取代反应 c.消去反应
d.酯化反应 e.水解反应 f.氧化反应
(2)反应②的化学方程式是___________________________。(3) A的结构简式是_________________。
(4)同时符合下列三个条件的B的同分异构体的数目有______个。
a含有间二取代苯环结构 b.属于非芳香酸酯 c.可与FeCl3溶液发生显色反应
写出其中任意一个同分异构体的结构简式__________________________________。
Ⅰ.2009年墨西哥、美国等地出现甲型H1N1流感疫情,引起全世界的关注,这种流感疫情是由甲型H1N1病毒引起的。美国疾病控制和预防中心推荐使用瑞士罗氏制药公司生产的“达菲”胶囊和英国葛兰素—史克公司生产的喷雾式药剂“乐感清”两款药物。
达菲和乐感清的结构简式如下图所示: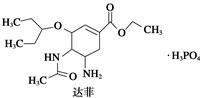

请回答下列问题:
(1)乐感清的分子式是____ 。
(2)合成达菲的主要原料莽草酸(结构简式为 
 )存在于我国盛产的八角茴香中。关于莽草酸性质的描述,下列说法正确的是( )
)存在于我国盛产的八角茴香中。关于莽草酸性质的描述,下列说法正确的是( )
A. 1 mol莽草酸与足量的金属钠反应可生成4mol H2。
B. 1 mol莽草酸与足量氢氧化钠溶液反应,最多可消耗氢氧化钠4 mol。
C. 1 mol莽草酸与足量的碳酸钠溶液反应可生成二氧化碳气体1 mol。
D. 1 mol莽草酸与足量的碳酸氢钠溶液反应可生成二氧化碳气体1 mol
(3)下列每组中各有三对物质,它们都能用分液漏斗分离的是
A.乙酸乙酯和水,酒精和水,植物油和水
B.四氯化碳和水,溴苯和水,硝基苯和水
C.甘油和水,乙酸和水,乙酸和乙醇
D.汽油和水,苯和水,乙二醇和水
Ⅱ.下图中A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3溶液发生反应,C和D的相对分子质量相等,且E为无支链的化合物。请回答下列问题:
(1)C分子中官能团的名称是 ;化合物B不能发生的反应是 (填字母序号)。
a.加成反应 b.取代反应 c.消去反应
d.酯化反应 e.水解反应 f.氧化反应
(2)反应②的化学方程式是___________________________。(3) A的结构简式是_________________。
(4)同时符合下列三个条件的B的同分异构体的数目有______个。
a含有间二取代苯环结构 b.属于非芳香酸酯 c.可与FeCl3溶液发生显色反应
写出其中任意一个同分异构体的结构简式__________________________________。
 )存在于我国盛产的八角茴香中。关于莽草酸性质的描述,下列说法正确的是( )
)存在于我国盛产的八角茴香中。关于莽草酸性质的描述,下列说法正确的是( )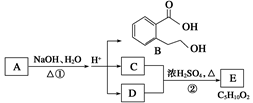
卤素单质的性质活泼,卤素的化合物应用广泛,研究卤素单质及其化合物具有重要意义。
(1)在光照条件下,氯气和氢气反应过程如下:
①Cl2→Cl+Cl ②Cl+H2→HCl+H ③H+Cl2→HCl+Cl
反应②中被破坏的化学键是——,氯元素的原子结构示意图为——。。
(2)二氧化氯(ClO2)是一种广泛用于水处理消毒剂,与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有害的有机氯化物。制备ClO2的方法有以下两种:
2NaClO3+4HCl===2ClO2↑+Cl2+2NaCl+2H2O…………………………①
2NaClO2+H2O2+H2SO4===2C1O2↑+O2↑+Na2SO4+2H2O …………………②
你认为哪种方法最佳 (填序号),理由是 。
(3)工业上用电解饱和食盐水的方法制取烧碱和氯气,请写出反应的离子方程式
。
(4)碘钨灯具有比白炽灯寿命长且环保节能的特点。一定温度下,灯泡内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)![]()
![]() WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t??2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
WI2(g)。为模拟上述反应,准确称取0.508g碘、0.736g金属钨置于50.0mL的密闭容器中,加热使其反应。如图是WI2(g)的物质的量随时间变化关系图象,其中曲线I(0~t??2时间段)的反应温度为T1,曲线II(从t2开始)的反应温度为T2,且T2>T1。则:①该反应的△H 0(填“大于”
或“等于”或“小于”)

②从反应开始到t1时间内的平均反应速率
v(I2)= 。
③下列说法中不正确的是 (填序号)。
A.该反应的平衡常数表达式是![]()
B.灯丝附近温度越高,灯丝附近区域WI2越易变为W而重新沉积到灯丝上
C.利用该反应原理可以提纯钨
(5)25℃时,向5mL含有KCl和KI浓度均为0.1mol/L的混合液中,滴加6mL0.1mol/L的AgNO3溶液,先生成的沉淀是 ,溶液中离子浓度由大到小的顺序是 [不考虑H+和OH-。25℃时KSP(AgCl)=1.8×10-10、KSP(AgI)=8.3×10-17]。
(6)Mg常用作提纯Ti的试剂,已知:
①Mg(s)+Cl(g)==MgCl2(s)△H=—641kJ/mol
②Ti(s)+2Cl2(g)===TiCl2(l) △H=—770kJ/mol
请写出Mg与液态TiCl4反应提纯钛的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com